Thermodynamique - Définition
On peut définir la thermodynamique de deux façons simples : la science de la chaleur et des machines thermiques ou la science des grands systèmes en équilibre. La première définition est aussi la première dans l'histoire. La seconde est venue ensuite, grâce aux travaux pionniers de Ludwig Boltzmann.
Avec la physique statistique dont elle est désormais une partie, la thermodynamique est l'une des grandes théories sur lesquelles se fonde la compréhension actuelle de la matière.
Science de la chaleur et des machines thermiques
Les notions de chaleur et de température sont les plus fondamentales de la thermodynamique. On peut définir la thermodynamique comme la science de tous les phénomènes qui dépendent de la température et de ses changements.
Chaleur et température
Chacun a une connaissance intuitive de la notion de température. Un corps est chaud ou froid, selon que sa température est plus ou moins élevée. Mais une définition précise est plus difficile. L’un des grands succès de la thermodynamique classique au XIXe siècle, est d'avoir donné une définition de la température absolue d’un corps : elle est mesurée en kelvin, zéro absolu = zéro kelvin = -273.15 degrés Celsius (environ).
La chaleur est encore plus difficile à définir. Une ancienne théorie, défendue notamment par Lavoisier, attribuait à un fluide spécial, (invisible, impondérable ou presque) les propriétés de la chaleur, le calorique, qui circulerait d’un corps à un autre. Plus un corps est chaud, plus il contiendrait de calorique. Cette théorie est fausse au sens où le calorique ne peut pas être identifié à une quantité physique conservée. Mais la thermodynamique donne quand même un sens à la notion de chaleur : il s'agit de la quantité d'énergie échangée par un système, avec un autre système ou le milieu extérieur.
Machines thermiques
La thermodynamique classique a pris son essor comme science des machines thermiques ou science de la puissance motrice du feu.
Sadi Carnot a initié les études modernes des machines thermiques dans un mémoire fondateur, Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance (1824). Le cycle de Carnot, étudié dans ce mémoire, reste le principal exemple théorique d’étude des machines thermiques. Plutôt que "puissance motrice", on dit aujourd’hui que les machines thermiques fournissent un travail et, on s’interroge sur la façon d’utiliser la chaleur pour produire du travail continu.
Le mouvement des corps macroscopiques, qui à l'échelle du millimètre et bien plus petit, peut produire de la chaleur, au sens où il rend les corps plus chauds. Il suffit de frotter ses mains pour s’en rendre compte. Inversement la chaleur peut mettre des corps macroscopiques en mouvement.
Les exemples sont très nombreux. On peut les appeler des machines à feu, ou machines thermiques. Elles sont des systèmes macroscopiques, qui conservent leur mouvement tant qu’une différence de température entre une partie chaude et une partie froide est maintenue.
Exemples
- Une simple bougie met en mouvement l’air qui l’entoure. Un courant ascendant est créé au dessus de la flamme. Il est perpétuellement renouvelé par un courant d’air froid arrivant par en dessous. On peut les observer dans une pièce calme avec une plume de duvet ou en approchant une autre flamme. Il s'agit d'un courant de convection.
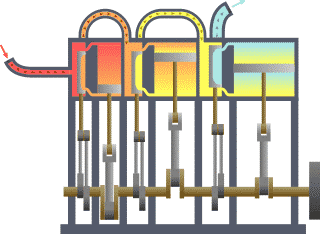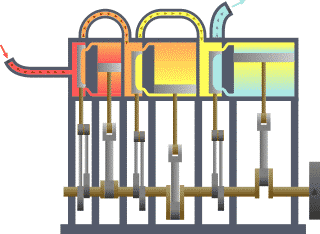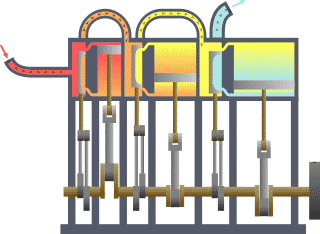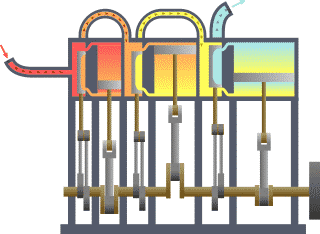
- L’eau dans une casserole sur le feu se met en mouvement comme l’air au dessus de la bougie et comme tous les fluides au dessus de surfaces suffisamment chaudes. Si on met un couvercle, un nouveau phénomène se produit. La vapeur soulève le couvercle, qui retombe ensuite pour être à nouveau soulevé, sans cesse jusqu’à épuisement du feu ou de l'eau, donc de la production de vapeur. On raconte que cette simple observation, que l’on peut faire dans toutes les cuisines, est liée à l’invention des machines à vapeur. Le mouvement du couvercle est trop petit pour être intéressant. Il s’arrête aussitôt commencé, car la vapeur qui le pousse s’échappe tout de suite. Mais si on met le couvercle dans un cylindre, on obtient un piston qui peut être poussé par la vapeur ou tout autre gaz sur une longue course. Les machines à vapeur et les moteurs thermiques ne sont pas toujours construits sur le principe du piston et du cylindre mais très souvent. Les autres solutions ne sont pas très différentes. On peut considérer que l’expérience du couvercle de la casserole est à l’origine des inventions de tous les moteurs thermiques.
- Les anciens connaissaient un exemple de turbine à vapeur. Une boule de métal est mobile en rotation sur un axe. L’eau qu’elle contient est chauffée par en dessous. Deux jets de vapeur tangentiels et opposés mettent alors la boule en mouvement. Mais ce système n’a pas vraiment été amélioré avant les temps modernes, pour en faire un moteur efficace. Les réacteurs des avions d’aujourd’hui (turbines à gaz) fonctionnent en grande partie sur le même principe que cet ancêtre de la turbine.
- La puissance motrice du feu a été beaucoup plus développée pour faire des armes. La balle, l’obus, ou tout autre projectile, est poussé dans le canon par le gaz très chaud produit par la combustion de la poudre ou de tout autre explosif. La chaleur du gaz sous pression ne fait pas la différence entre un obus dans un canon et un piston dans un cylindre.
- Les fluides de la surface terrestre, l’atmosphère et les océans, sont mis en mouvement par la chaleur du Soleil. Pour les océans, la gravitation joue aussi un rôle, les marées. La puissance du vent est donc une forme de la puissance motrice du feu.
- Et beaucoup d’autres encore.
Science des grands systèmes en équilibre
Définir la thermodynamique comme la science de l’équilibre des grands systèmes est une approche à la fois très rigoureuse et très générale.
Équilibre statistique et loi des grands nombres
Si l’on jette un même dé, bien équilibré, un grand nombre de fois, on est sûr par avance que les fréquences d’apparition de chacune des faces seront proches de un sixième. Plus le nombre de lancers est grand, plus les fréquences sont égales parce que le dé explore également toutes les possibilités qui lui sont offertes. La même chose se produit si on verse une goutte de colorant dans un verre d’eau. Si on attend assez longtemps, le verre est devenu uniformément coloré parce que toutes les molécules ajoutées explorent également toutes les possibilités, les régions à l’intérieur du verre, qui leur sont offertes.
Ces observations peuvent être généralisées. Lorsqu’un système est très grand, et lorsqu’il y a un sens à parler de l’équilibre du système, on peut prédire avec certitude la destinée de l’ensemble alors même que les destinées des nombreux individus sont indéterminées.
Petitesse des atomes
On sait aujourd’hui que les atomes existent vraiment et qu’ils sont très petits. Autrement dit, dans chaque échantillon de matière il y a un très grand nombre d’atomes, des milliards de milliards dans un minuscule grain de sable. La physique des corps macroscopiques est donc toujours une physique des grands systèmes.
Équilibres thermiques
L’étude des équilibres thermiques a une immense portée. Toutes les formes de la matière (gaz, liquides, solides, semi-fluides,...) et tous les phénomènes physiques (mécaniques, électriques et magnétiques, optiques,...) peuvent être étudiés en raisonnant sur l’équilibre des grands systèmes. La thermodynamique, que l’on identifie alors plutôt à la physique statistique, est une des bases les plus solides sur laquelle est édifiée notre compréhension de la matière.
Lois de la thermodynamique
Les deux principes les plus importants sont le premier et le second. On leur en ajoute parfois deux autres (n°0 et n°3).
- Le premier principe affirme que l'énergie est toujours conservée. Autrement dit, l’énergie totale d’un système isolé reste constante. Les événements qui s’y produisent ne se traduisent que par des transformations de certaines formes d’énergie en d’autres formes d’énergie. L’énergie ne peut donc pas être produite ex nihilo ; elle est en quantité invariable dans la nature. Elle ne peut que se transmettre d’un système à un autre. On ne crée pas l’énergie, on la transforme.
Le premier principe de la thermodynamique est aussi une loi générale pour toutes les théories physiques (mécanique, électromagnétisme, physique nucléaire,...) On ne lui a jamais trouvé la moindre exception, bien qu'il y ait parfois eu des doutes, notamment à propos des désintégrations radioactives. On sait depuis le théorème de Noether que la conservation de l'énergie est étroitement reliée à une uniformité de structure de l'espace-temps.
On attribue à Lavoisier la citation suivante : " rien ne se perd, rien ne se crée, tout se transforme ".
- Le second principe concerne la notion d'irréversibilité d'une transformation et introduit la notion d'entropie. Il dit que l'entropie d'un système isolé augmente, ou reste constante. Il est associé à l'impossibilité du passage du désordre à l'ordre sans intervention extérieure. Mais cette interprétation pose des difficultés.
Le second principe a une origine statistique : à la différence du premier principe, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statistique. En revanche, il est assez indépendant des caractéristiques mêmes de ces lois, car il apparaît également si l'on suppose des lois simplistes à petite échelle.
- Le principe zéro concerne la notion d'équilibre thermique et est à la base de la thermométrie. Si deux systèmes sont en équilibre thermique avec un même troisième alors ils sont aussi ensemble en équilibre thermique.
- Le troisième principe, ou principe de Nernst est plus controversé. Il est associé à la descente vers son état quantique fondamental d'un système dont la température se rapproche d'une limite qui définit la notion de zéro absolu. Il n'est pas nécessaire pour la thermodynamique classique et n'est donc pas vraiment un principe de la thermodynamique.
Grandeurs extensives et intensives
Parmi les grandeurs physiques qui déterminent l'état thermodynamique d'un système on distingue les grandeurs extensives et intensives.
Un système peut toujours être divisé - par la pensée - en parties qui occupent des régions disjointes de l'espace.
Une grandeur est extensive lorsque sa valeur pour le système entier est la somme de ses valeurs pour chacune de ses parties. Exemples :
- Le volume
- La masse
- Le nombre de particules d'une espèce déterminée
- L'énergie et l'entropie - dans de nombreux cas
- La charge électrique (il faut alors entendre somme au sens de somme algébrique)
Une grandeur est intensive lorsque dans un système homogène sa valeur est la même pour le système entier et pour chacune de ses parties. Exemples :
- La pression
- La température
- La masse volumique, l'énergie par unité de volume, ou de masse - dans de nombreux cas - et tout quotient de deux grandeurs extensives
Une grandeur peut n'être ni extensive ni intensive, le carré du volume par exemple. On définit ce genre de grandeur pour trouver des relations entre celle-ci qui auront des propriétés différentes selon qu'une grandeur soit extensive ou intensive d'où l'intérêt de les distinguer.
Paramètres d'états: les variables d'état sont des grandeurs (indépendantes) qui servent à définir le système et dont il suffit de fixer la valeur pour reconstituer un système exactement identique. Grandeurs intensives: indépendants de la quantité de matière: la pression, la température, la viscosité, etc. Grandeurs extensives: proportionnelles à la quantité de matière: volume; énergie interne, enthalpie, etc.