Fonction d'état, variable d'état, équation d'état - Définition
Fonction d’état
Il existe des grandeurs qui définissent l’état d’équilibre d’un système thermodynamique. Ces grandeurs sont appelées fonctions d'état et possèdent une propriété particulière: leurs variations ne dépendent pas de la nature de la transformation qui affecte le système. Elles dépendent uniquement des états final et initial du système à l'équilibre.
Exemple de compréhension
Considérons la fonction altitude A lors d’une randonnée en montagne. Pour aller d’un sommet (1) à 2500m à un sommet (2) à 2600m, deux chemins s’offrent aux randonneurs :
- un premier chemin qui suit la ligne de crête presque au niveau des deux sommets,
- un deuxième chemin qui redescend dans la vallée à 500m d’altitude.
La variation d’altitude ΔA est la même pour les deux chemins :
- ?A = A(2) – A(1) = 100m
La fonction altitude pourrait être considérée comme une fonction d’état de la randonnée. En revanche, les efforts consentis, travail et chaleur dégagée par les randonneurs ne seront pas identiques ! Ces grandeurs ne sont pas des fonctions d’état mais des grandeurs liées au chemin suivi.
Il en est de même en thermodynamique, pour le travail et la chaleur qui dépendent de la nature de la transformation affectant un système. Néanmoins il existe des cas particuliers où la chaleur et le travail ne dépendent plus du chemin suivi lorsque les transformations s’effectuent soit à pression constante ( voir enthalpie), soit à volume constant ( voir énergie interne).
Variables d’état
Certaines fonctions d’état jouent un rôle particulier dans la définition des états d’équilibre d’un système. Ce sont des grandeurs accessibles, à l’échelle macroscopique, directement ou indirectement grâce à des instruments de mesure :
- La pression p exprimée en Pa ( Pascal)
- La température T exprimée en K (Kelvin)
- Le volume V exprimé en m3
- La quantité de matière n exprimée en mol.
Ces fonctions d’état particulières sont appelées variables d’état d’équilibre d’un système thermodynamique.
Certaines de ces variables d’état sont intensives comme la température et la pression. Cela signifie qu’elles ne dépendent pas de la quantité de matière du système.
Exemple : si on mélange deux bouteilles contenant 1L d’eau chacune, à la température de 20°C, la température finale est 20°C et non pas 40°C. Il en serait de même avec la pression qui ne présente pas non plus la propriété d’additivité. En revanche, le volume V final sera égal à 2 L. Le volume n’est pas une grandeur intensive mais une grandeur extensive qui dépend de la quantité de matière du système. La quantité de matière n est elle aussi une grandeur extensive.
Équation d’état
Les variables d’état définissant l’état d’équilibre d’un système, p, V, T, n, ne sont pas indépendantes. Elles sont liées par une relation appelée équation d’état du système, plus ou moins complexe.
Par exemple, l’équation d’état la plus simple est celle du gaz parfait (modèle idéalisé d'un gaz constitué de particules suffisamment éloignées les unes des autres pour considérer qu'il n'y a aucune interaction d'ordre électrostatique entre elles ; cela implique que la pression est faible). Dans ces conditions, l'équation d'état est indépendante de la nature chimique du gaz considéré comme parfait :
-
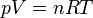
En mesurant T et p pour n (mol.) de gaz parfait on peut alors calculer le volume et définir parfaitement son état d'équilibre :
Pour définir l’état d’une quantité donnée d'un gaz parfait (n fixé), 2 variables indépendantes suffisent ( cette propriété peut être étendue à tous les corps purs, qu'ils soient solides, liquides ou gazeux ).
De nombreux gaz réels dans les conditions normales de température et de pression vérifient, avec une excellente approximation, le modèle du gaz parfait. C'est le cas des gaz constituants de l'air : le diazote (N2) et le dioxygène (O2).
Propriété fondamentale des fonctions d'état
Rappel de définitions mathématiques
La différentielle d'une fonction d'état, fonction de plusieurs variables indépendantes, est une différentielle totale exacte. Cela signifie qu'elle est égale à la somme de ses différentielles partielles par rapport à chaque variable.
- La différentielle d'une fonction F(x) est égale au produit de la dérivée de F par la différentielle de la variable x:
dF = F’(x). dx
- Pour une fonction de plusieurs variables, par exemple F(x,y):
dF = F’/x. dx + F’/y. dy
ou encore:
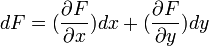
- Application: si F est fonction de plusieurs variables au cours d'une transformation, on peut décomposer cette transformation en plusieurs étapes de telle manière que pour chaque étape une seule variable indépendante varie, ce qui rend l'étude plus simple. La variation globale de F sera égale à la somme des variations partielles de chaque étape et sera bien évidemment identique à la variation obtenue au cours de la transformation effectuée en une seule étape; toutes les variables variant simultanément.
Considérons une transformation définie par l'état initial A: F(A); x(A); y(A) et l'état final C: F(C); x(C); y(C).
On définit un état intermédiaire B: F(B); x(B) = x(C); y(B) = y(A).
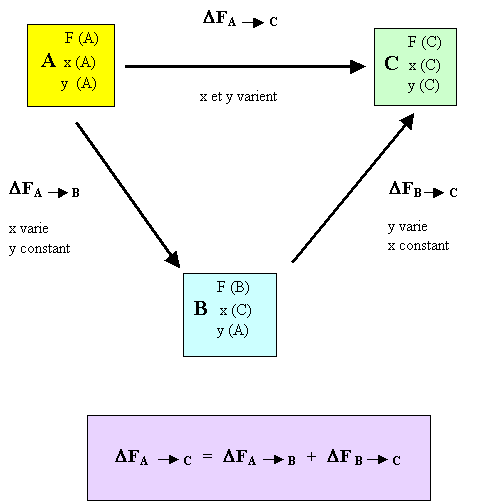
On dit alors que la variation de la fonction d'état ne dépend pas du chemin suivi.
Calculons la variation de la fonction:
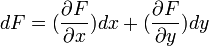
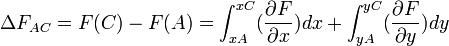
Remarque: L'ordre de variation des variables indépendantes x et y n'a aucune incidence sur le résultat. Cela se traduit mathématiquement par le fait que les dérivées secondes croisées de la fonction F par rapport à x et y sont égales.
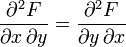
Exemple d'application: cas du gaz parfait
- L'équation d'état du gaz parfait est simple: pV = nRT. Le volume V, variable d'état est aussi une fonction d'état. Si n ( nombre de mole de gaz) est constant, le volume V dépend de deux variables indépendantes: V = nRT/p = f( p, T).
Si on procède à une transformation de l'état initial A défini par V(A); T(A); p(A), à l'état final C défini par V(C); T(C); p(C), la variation de volume ΔV sera égale à V(C)- V(A).
Il est possible de calculer simplement cette variation de volume grâce à l'équation d'état.
Etat C: p(C)V(C) = nR T(C) d'où V(C) = nR T(C)/ p(C)
Etat A: p(A)V(A) = nR T(A) d'où V(A) = nR T(A)/ p(A)
Et donc
![\Delta V = V(C) - V(A) = nR[\frac{\ T_C}{\ p_C} - \frac{\ T_A}{\ p_A}]](https://static.techno-science.net/illustration/Definitions/autres/3/36bd0050b9a41ed399d60b89b801c9d8_eb8b539f211fe3b0ff0a23eab3650ccf.png)
- Vérifions maintenant que la transformation A B C (voir figure antérieure) aboutit au même résultat puisque V est une fonction d'état et que sa différentielle totale est exacte.
On peut écrire:
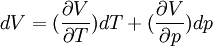
Or d'après l'équation d'état
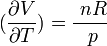
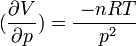
d'où
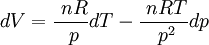
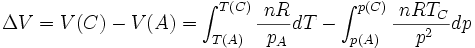
![\Delta V = V(C) - V(A) = \frac{\ nR}{\ p_A} (T_C - T_A) + nRT_C [\frac{\ 1}{\ p_C} - \frac{\ 1}{\ p_A}]](https://static.techno-science.net/illustration/Definitions/autres/7/7c7e5f07afb369b1aa221b008480530c_73dfccff3b5b32c837912e0b0fd61f01.png)
d'où
![\Delta V = V(C) - V(A) = nR[\frac{\ T_C}{\ p_C} - \frac{\ T_A}{\ p_A}]](https://static.techno-science.net/illustration/Definitions/autres/3/36bd0050b9a41ed399d60b89b801c9d8_eb8b539f211fe3b0ff0a23eab3650ccf.png)
Le volume est bien une fonction d'état.
- Pour que la forme différentielle dV de la fonction V(T, p) soit une différentielle totale exacte, il faut que l'ordre de la dérivation de V par rapport à T et p soit indifférent ou encore que les dérivées secondes croisées soient égales.
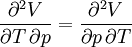
Ce qui est le cas:
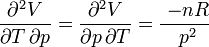
- En revanche, la forme différentielle du travail des forces de pression δW = - pdV, n'est pas une différentielle exacte ce qui signifie que le travail n'est pas une fonction d'état et donc que la quantité mise en jeu dépend du chemin suivi.
Démontrons le dans le cas d'un gaz parfait à l'aide du critère des dérivées secondes croisées.
Nous avons établi précédemment la différentielle du volume d'un gaz parfait:
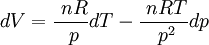
donc la forme différentielle du travail est égale à:
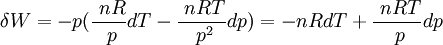
Cela signifie que:
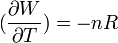
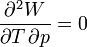
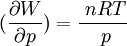
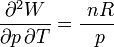
Donc les dérivées secondes croisées ne sont pas égales.
La forme différentielle du travail n'est pas une différentielle exacte et il s'ensuit que le travail n'est pas une fonction d'état.
Intérêt de la propriété des fonctions d'état en thermodynamique
Les transformations réelles sont irréversibles et leur déroulement dépend de la façon de procéder. Elles ne sont donc pas modélisables mathématiquement et le calcul des grandeurs thermodynamiques qui leurs sont associées, est impossible. Néanmoins, si cette grandeur est une fonction d'état, sa variation ne dépend que de l'état final et de l'état initial d'équilibre. Pour calculer cette variation il suffit alors d'imaginer une transformation réversible, partant du même état initial pour aboutir au même état final que pour la transformation réelle. Cette transformation réversible est caractérisée par une succession d'états d'équilibres. Elle est modélisable mathématiquement et sa variation est donc calculable.
Cette variation est identique à celle observée pour la transformation irréversible et le problème est résolu.
En outre si la fonction d'état est fonction de plusieurs variables, on pourra décomposer la transformation en autant d'étapes intermédiaires réversibles qu'il y a de variables; chaque étape étant caractérisée par la variation d'une seule variable indépendante. Cela simplifie grandement les calculs.
Fonctions d’état usuelles en thermodynamique
- L’énergie interne : U exprimée en J (Joule),
- L’enthalpie : H = U + pV exprimée en J,
- L’entropie : S exprimée en J.K-1,
- L’énergie libre : F = U – T.S exprimée en J,
- L’enthalpie libre : G = H – T.S exprimée en J.


















































