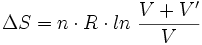Détente de Joule et Gay-Lussac - Définition
La détente de Joule Gay-Lussac est une détente dans le vide. Un gaz obéissant aux lois de Joule est enfermé dans un récipient de volume v. Il est ensuite brusquement mis en contact avec un récipient de volume v'.
Calcul de la température après la détente
On calcule la variation d'énergie interne du système v + v' : comme le système est adiabatique et de volume constant, il n'y a ni échanges de travail ni échanges de chaleur avec l'extérieur. D'après le premier principe de la thermodynamique, il n'y a donc pas de variations d'énergie interne
Le gaz considéré est un gaz de Joule (puisque c'est un gaz parfait). On peut donc conclure que la température ne varie pas.
Note : La plupart des gaz réels ne sont pas des gaz de Joule, cette expérience doit donc être menée avec des gaz très particuliers.
Variation d'entropie
Pour un gaz parfait, la variation d'entropie (le désordre d'un système fermé ne peut aller qu'en s'amplifiant) pendant une réaction s'écrit (T0 et V0 étant respectivement la température et le volume à l'origine, n la quantité de matière de gaz) :
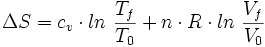
Ainsi, la variation d'entropie lors de la détente de Joule Gay-Lussac est :