Diagramme de phase - Définition
Un diagramme de phase est une expression utilisée en thermodynamique (voir Phase) ; elle indique une représentation graphique, généralement à deux ou trois dimensions, représentant les domaines de l'état physique (ou phase[1]) d'un système (corps pur ou mélange de corps purs), en fonction de variables, choisies pour faciliter la compréhension des phénomènes étudiés.
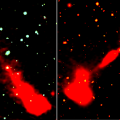
Les diagrammes les plus simples concernent un corps pur avec pour variables la température et la pression ; les autres variables souvent utilisées sont l'enthalpie, l'entropie, le volume massique, ainsi que la concentration en masse ou en volume d'un des corps purs constituant un mélange.
Lorsque le système étudié est un mélange de n corps purs, son état physique est défini par les (n-1) proportions indépendantes de ses composants, ainsi que par la température et la pression. Ainsi, un diagramme à deux variables ne peut donc être établi qu'en fixant (n-1) variables du système.
C'est un diagramme à l'équilibre qui ne permet pas de décrire un système dans un état métastable comme, par exemple, de l'eau liquide à une température inférieure à 0 °C à la pression atmosphérique normale (surfusion).
Diagramme de phase d'un corps pur
Un corps pur se présente sous une ou plusieurs de ses phases solides, liquide et gazeuse[2], en fonction des conditions de pression et de température. Généralement, un corps pur existe sous une seule phase pour une pression et une température données, sauf :
- au point triple, où les 3 phases coexistent à une température et une pression données ;
- pour un couple (pression, température) correspondant à un changement d'état (ou transition de phase) soit :
- entre 2 phases solides : transformation entre 2 variétés allotropiques ;
- entre une phase solide et une phase liquide : fusion - solidification ;
- entre une phase solide et une phase vapeur (gaz) : sublimation - condensation ;
- entre une phase liquide et une phase vapeur : vaporisation - liquéfaction ; la courbe de changement d'état liquide-vapeur s'interrompt en un point appelé point critique, au-delà[3] duquel le corps ne présente plus qu'une seule phase fluide, plutôt proche (du point de vue de ses propriétés physiques) d'un gaz[4] aux pressions inférieures à la pression critique, plutôt proche d'un liquide aux pressions supérieures à la pression critique.
Lorsque toutes les phases représentées correspondent à des états physiques différents, on parle parfois de diagramme de changement d'état.
En règle générale, les courbes de changement d'état sont croissantes dans le diagramme
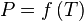
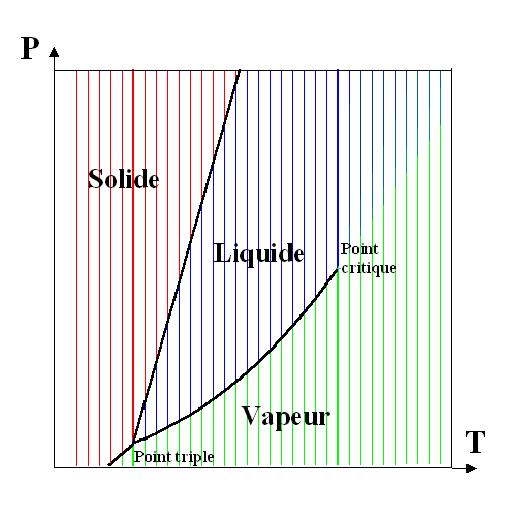
Exemple d'un diagramme de phase de corps pur
Il faut remarquer qu'un corps pur placé au contact de l'atmosphère ne constitue pas un système à un corps pur, ce qui explique, par exemple, que l'eau coexiste habituellement à l'état liquide et à l'état de vapeur à la température ambiante, très éloignée de sa température d'ébullition (100 °C à la pression atmosphérique normale).
À l'état solide, un corps peut parfois prendre plusieurs formes de cristallisation, selon le domaine de pression et de température. Chaque forme de cristallisation constitue ainsi une phase différente, ce qui permet de tracer un diagramme de phase.
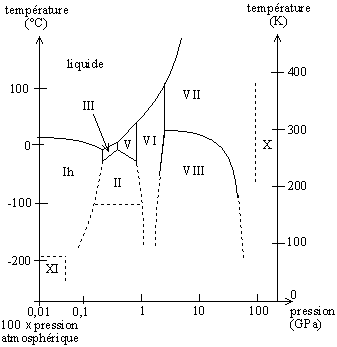
Exemple d'un diagramme de phase pour plusieurs formes de cristallisation : la glace — par rapport au diagramme précédent, les axes sont inversés, et l'échelle des pressions est logarithmique
Diagramme binaire et ternaire
Lorsque l'on a un système composé de deux corps purs, le système peut être sous plusieurs formes :
- entièrement solide, chaque corps cristallisant séparément ;
- entièrement solide, les deux corps étant parfaitement mélangés sous la forme d'une solution solide ou d'un composé défini, appelé eutectique, eutectoïde, péritectique ou péritectoïde selon la manière dont il se décompose en chauffant ;
- mélange solide-liquide ;
- entièrement liquide, sous la forme de deux liquide non miscibles (émulsion), ou d'un seul liquide parfaitement homogène (une seule phase, solution) ;
- mélange liquide-gaz (aérosol, ou bien gaz au-dessus d'un liquide) ;
- gaz (un gaz est toujours homogène pour de faibles variations d'altitude).
Les états ci-dessus sont composés soit d'une phase unique (par exemple liquides miscibles ou gaz), soit de plusieurs phases hétérogènes. On peut tracer de même l'état d'un système en fonction de la pression, de la température et de la composition.
Avec n corps purs, nous avons n concentrations, mais seulement n+1 paramètres indépendants avec la pression et la température ; en effet, la somme des concentrations vaut 100 %, et l'une des concentrations peut se déduire des autres et ne constitue donc pas un paramètre indépendant.
Il faudrait donc un diagramme à n+1 dimensions pour représenter ces n+1 paramètres indépendants (3 dimensions pour deux corps purs, 4 dimensions pour trois corps purs). Pour simplifier la représentation, un nombre suffisant de paramètres sont fixés afin de tracer un diagramme à deux dimensions ; on considère souvent les diagrammes suivants :
- pour une composition donnée, le diagramme de phase pression-température (P,T), similaire à ce qui a un diagramme de corps pur ;
- pour une pression donnée et deux corps purs, le diagramme binaire composition-température (c,T) ;
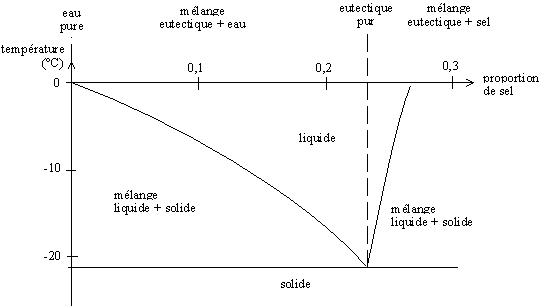
Exemple de diagramme binaire : le diagramme eau-sel sous une atmosphère
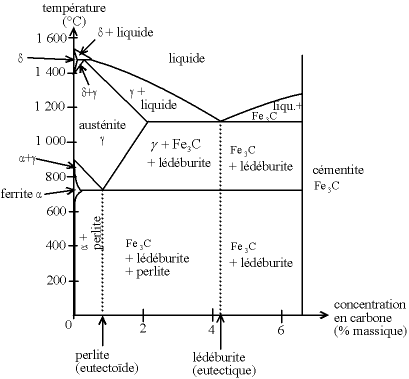
Exemple de diagramme binaire : le diagramme fer-carbone sous une atmosphère
- pour une pression et une température données et trois corps purs, le diagramme ternaire (c1,c2), c'est-à-dire la phase en fonction de la composition ; par habitude, et bien que l'on ait c3 = 1-c1-c2, on trace ce diagramme dans un triangle équilatéral (c1,c2,c3)
Diagramme à solution solide unique
Dans certains cas, comme par exemple pour les alliages argent-or, il n'y a pas de composé défini. Dans ces cas-là, le diagramme binaire est très simple, comme illustré ci-dessous :
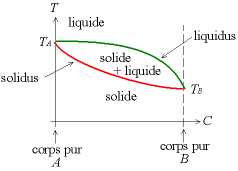
On a
- TA la température de fusion du corps pur A ;
- TB la température de fusion du corps pur B.
On définit :
- le liquidus : au-dessus de cette courbe, le produit est entièrement liquide (c'est la courbe du haut) ; le liquidus définit la composition du liquide qui est à l'équilibre avec un solide à une température donnée ;
- le solidus : en dessous de cette courbe, tout le produit est solide ; le solidus définit la composition d'un solide qui est en équilibre avec un liquide à une température donnée.
Entre le liquidus et le solidus, on a un mélange solide-liquide. Ce diagramme permet de prédire la manière dont va se passer une solidification (voir cet article).
Composés définis
Les composés définis sont des composés dont le changement de phase se fait à température constante. On distingue :
- les eutectiques : un eutectique fond à température constante, il se comporte en fait comme un corps pur ;
- les eutectoïdes : les eutectoïdes subissent une transformation de phase solide-solide à température constante ; la seule différence avec les eutectiques est que la phase au-delà de la température limite n'est pas liquide ;
- les péritectiques : il y a une transformation solide A → solide B + liquide à température constante ;
- les péritectoïdes : il y a une transformation solide A → solide B + solide C à température constante.
Diagramme (P, V, T)
Dans le cas des changements d'état (gaz-liquide-solide) d'un corps pur, les résultats sont parfois présentés sous la forme d'un diagramme en trois dimensions, les axes étant la pression P, le volume V occupé par le système et la température T.
diagramme (P, V, T) pour un corps pur classique
diagramme (P, V, T) pour l'eau
Ce diagramme tridimensionnel est en fait construit à partir de trois types de diagrammes utilisés en thermodynamique : les diagrammes de changement d'état, les diagrammes isothermes de Clapeyron et les diagrammes isobares.
Les figures ci-dessous montrent les diagrammes thermodynamiques comme des " coupes " ou des " projections " du diagramme (P, V, T). La flèche indique la direction de projection.
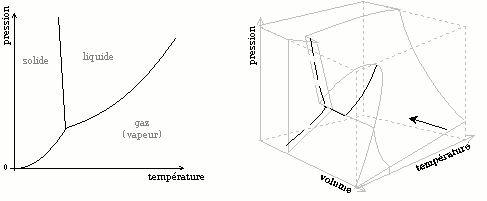
Diagramme (P, V, T) et diagramme (T, P) de changement d'état d'un corps pur
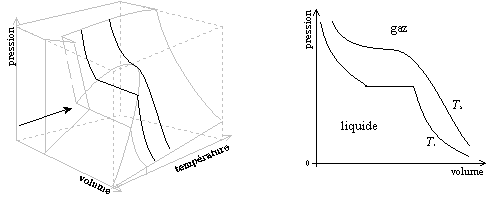
Diagramme (P, V, T) et diagramme isotherme de Clapeyron
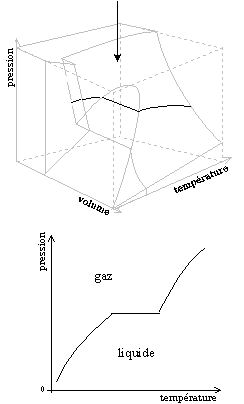
Diagramme (P, V, T) et diagramme isobare (V, T)
Comment établit-on un diagramme de phases ?
Le diagramme de phase s'établit expérimentalement : on fait varier les conditions et l'on observe les changements de phase.
Les changements de phase peuvent s'observer de plusieurs manières :
- certains produisent de la chaleur (par exemple la condensation ou une réaction chimique exothermique) ou en absorbent (par exemple la fusion ou des réactions chimiques endothermiques), donc en mesurant les flux de chaleur, on sait si un changement de phase a lieu ; c'est l'analyse thermodifférentielle (ATD) ;
- certains induisent un changement de volume, une contraction (comme la condensation ou le réarrangement des atomes d'un solide dans une configuration plus compacte) ou une expansion (comme la vaporisation ou le réarrangement des atomes d'un solide dans une configuration moins compacte), il suffit alors de mesurer les changements de volume, par exemple avec un piston mobile, la force étant imposée par le poids d'une masse ou bien par un système hydraulique ;
- on peut à l'inverse observer les variations de pression, avec un manomètre, en imposant le volume avec un piston mobile actionné par une vis sans fin ;
- observer à l'œil nu l'état du système (par exemple la fusion des cristaux) ;
- pour les différentes phases solides, on peut reconnaître les différentes phases cristallines par diffraction de rayons X ; on peut faire l'analyse sur l'échantillon chaud, ou bien tremper l'échantillon, c'est-à-dire lui faire subir un refroidissement rapide afin qu'il conserve sa structure d'équilibre à chaud même lorsqu'il est froid (il n'est donc pas à l'équilibre).
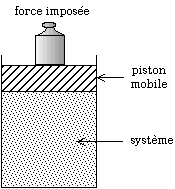
Dispositif expérimental permettant de mesurer les variations de volume en imposant la pression
La courbe de solidification, utilisée pour déterminer la température de changement d'état, est de l'analyse thermodifférentielle simplifiée ; elle consiste à laisser refroidir un liquide et à mesurer sa température. La vitesse de perte de chaleur est proportionnelle à la différence de température entre le système et l'extérieur, on a donc une courbe exponentielle. Lorsque l'on observe un plateau, cela signifie que l'échantillon libère de la chaleur, ce qui est caractéristique de la solidification. Lors d'un changement de phase (changement de structure cristalline) dans le solide on peut observer un plateau de la même manière.
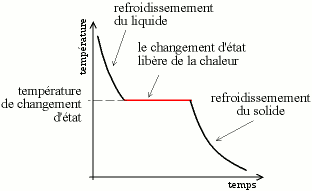
Courbe de solidification, isobare, refroidissement passif, cas d'un corps pur ou d'un alliage eutectique
Notes
- ↑ En physique, on appelle phase un corps pur ou un mélange homogène de corps purs qui est dans un état (gazeux, liquide, solide amorphe, solide cristallisé selon telle ou telle forme) donné.
- ↑ À de hautes températures, un corps pur se présente sous la forme d'un plasma, considéré comme le quatrième état de la matière.
- ↑ Température supérieure à la température critique ou pression supérieure à la pression critique.
- ↑ Un gaz dont la température est supérieure à sa température critique est qualifié de supercritique ; il est impossible de le liquéfier par seule compression.