Conductimétrie - Définition
Une solution ionique est conductrice de l'électricité. La présence d'ions, chargés électriquement, assure le caractère conducteur de la solution. La conductimétrie permet de mesurer les propriétés conductrices d'une telle solution.
En pratique, on détermine la conductance G d'un volume d'une solution à l'aide d'une cellule de mesure constituée de deux plaques parallèles de surface S et séparées d'une distance l.
Conductivité σ d'une solution ionique
La valeur de la conductance G d'une solution ionique dépend de la nature de la solution, ainsi que de la géométrie de la cellule de mesure. Elle peut être déterminée par la relation :
avec G en siemens (S), S en mètre carré (m2), l en mètre (m) et σ en siemens par mètre (S.m-1).
Par ailleurs la conductance est l'inverse de la résistance :
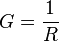
On peut donc à l'aide d'une simple cellule, d'un générateur de tension U et d'un ampèremètre branché en série, déduire la conductance à l'aide de la loi d'Ohm :
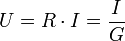
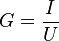
On appelle σ la conductivité de la solution. Cette grandeur est caractéristique de la solution. Elle dépend :
- de la nature des ions qui la composent,
- de leurs concentrations,
- de la température de la solution.
Un conductimètre, préalablement étalonné, permet d'afficher directement la valeur de la conductivité σ de la solution.
La conductivité vérifie l'égalité suivante:
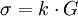
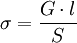
σ en S.m-1, k constance de cellule, G en S, l espace entre les deux cellules du conductimètre immergés dans la solution en m, S surface de ces cellules en m2.
Conductivité molaire ionique λi
Espèces monochargées
La valeur de la conductivité σ peut être calculée à partir des conductivités molaires ioniques λi des ions qui composent cette solution (voir tableau ci-dessous donné à titre indicatif), ainsi que de leur concentration [Xi] :
avec σ en S.m-1, λi en S.m2.mol-1 et [Xi] en mol.m-3.
| ion | λ (mS.m2.mol-1) |
| H3O+ | 34,98 |
| HO- | 19,86 |
| Br- | 7,81 |
| Rb+ | 7,78 |
| Cs+ | 7,73 |
| I- | 7,68 |
| Cl- | 7,63 |
| K+ | 7,35 |
| NH4+ | 7,34 |
| NO3- | 7,14 |
| Ag+ | 6,19 |
| MnO4- | 6,10 |
| F- | 5,54 |
| Na+ | 5,01 |
| CH3COO- | 4,09 |
| Li+ | 3,87 |
| C6H5COO- | 3,23 |
On remarque que les ions H30+ et HO- ont, e solution aqueuse, une conductivité molaire ionique plus importante que celle des autres ions. Ces deux ions étant des dérivées de l'eau leur mobilité dans l'eau est en effet très importante.
Cependant, dans le cas de l'eau pure, leur concentration est très faible (10-7 mol.L-1) et leur contribution est donc négligeable : une solution d'eau pure ne conduit que très peu l'électricité.
Exemple : si on pose la conductivité d'une solution de chlorure de sodium de concentration c = [Cl-] = [Na+] = 2,00 mol.m-3 est égale à :
- σ = λCl-.[Cl-] + λNa+.[Na+]
- σ = 7,63.10-3 x 2,00 + 5,01.10-3 x 2,00 = 2,53.10-2 S.m-1.
Espèces polychargées
Si les ions portent plusieurs charges, les tables de valeurs donnent généralement les conductivités molaires spécifiques, c'est-à-dire ramenées à l'unité de charge.
![\sigma = \sum z^i\lambda_i \cdot [X_i]](https://static.techno-science.net/illustration/Definitions/autres/6/6df9fa11ef2ef95dd6438d8d88d72599_be904111049a43e31e4cbdd202c4a0b4.png)
Méthodes conductimétriques
Les mesures de conductimétrie permettent de déterminer la concentration des ions contenus dans cette solution. Elles sont très utilisées en chimie pour :
- des dosages,
- des déterminations de cinétique chimique,
- des déterminations de constantes d'équilibres thermodynamiques (constante de solubilité par exemple).
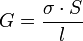
![\sigma = \sum \lambda_i \cdot [X_i]](https://static.techno-science.net/illustration/Definitions/autres/c/c4c9b5e0b34b869a1ceec5b066ba9702_c6d018a92c0009b666d12430e50d611f.png)

















































