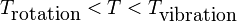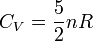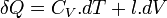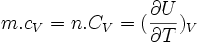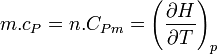Capacité thermique - Définition
La capacité thermique (ou capacité calorifique) d'un corps est une grandeur permettant de quantifier la possibilité qu'a un corps d'absorber ou restituer de l'énergie par échange thermique au cours d'une transformation pendant laquelle sa température varie.
Signification physique
Toute chose étant égale par ailleurs, plus la capacité thermique d'un corps est grande, plus grande sera la quantité d'énergie échangée au cours d'une transformation s'accompagnant d'une variation de la température de ce corps. La capacité thermique est la donnée de l'énergie qu'il faut apporter à un corps pour augmenter sa température de un Kelvin. Elle s'exprime en Joule. C'est une grandeur extensive : plus la quantité de matière est importante plus la capacité thermique est grande.
On peut déduire de la capacité thermique d'un corps de masse m et de quantité de matière n, deux grandeurs associées intensives :
- La capacité thermique massique
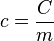
- La capacité thermique molaire
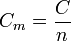
Histoire
Avant le développement de la thermodynamique moderne, on pensait que la chaleur était un fluide (vison dite substantialiste) : le fluide calorique. Les corps étaient donc susceptibles de contenir une certaine quantité de ce fluide d'où l'appellation capacité calorifique. Pour des raisons historiques, la calorie[1] était définie comme la " chaleur " nécessaire pour élever de 15 °C à 16 °C la température d'un gramme d'eau, d'où le nom de capacité calorifique.
Aujourd'hui, on considère que l'énergie interne des systèmes est constituée des énergies cinétique et potentielle microscopiques. La chaleur n'est plus un fluide ni une énergie en soi, c'est un mode de transfert d'énergie : un transfert microscopique et désordonné.
La capacité calorifique, est désormais désormais appelée capacité thermique.
Capacité thermique molaire à volume constant
On appelle capacité calorifique molaire à volume constant
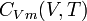
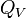
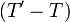
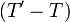
-
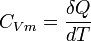
Il convient toujours de préciser que lors d'une petite variation d'un état
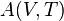
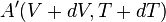
-
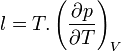
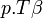
L'énergie thermique échangée au cours d'une transformation est donc :
où
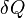
Capacité calorifique molaire à pression constante
C'est le même raisonnement mais en gardant cette fois la pression
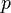
On introduit alors un coefficient de chaleur latente de compression
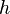
-
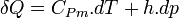
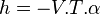
Plus précisément la capacité thermique isobare d'un corps pur monophasé est définie à partir de son enthalpie H = U + p.V :
Relation de Mayer
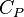
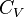
Variation avec la température pour un gaz parfait
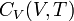
- Pour un gaz parfait monoatomique (GPM), on considère que
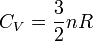
- Pour un gaz parfait diatomique (GPD), on considère que dans une plage de température comprise entre