Aneuploidie und ihre Auswirkungen auf die Zelle
Aneuploidie, ein Zustand, bei dem Zellen eine falsche Anzahl von Chromosomen aufweisen, wird in 90 % der soliden Tumore beobachtet. Sie resultiert aus Fehlern bei der Verteilung der Chromosomen von der Mutterzelle zu den beiden Tochterzellen während der Mitose, also der Zellteilung, und führt zur Aktivierung von p53, einem Schlüsselprotein, das die Teilung abnormaler Zellen verhindert.
Wenn p53 mutiert ist, was durchschnittlich bei jedem zweiten Krebs der Fall ist, können diese Zellen weiterhin teilnehmen, zusätzliche Mutationen ansammeln und schließlich zur Entstehung von Krebs führen. Wie die Anomalien der Chromosomenzahl erkannt werden, um diesen Signalweg zu aktivieren, bleibt eine offene Frage in der Krebsforschung.
Die Rolle der Kernmechanik bei der Erkennung von Verteilungsfehlern
Mithilfe eines genetischen Systems, das es ermöglicht, abnormale Mitosen kontrolliert auszulösen, haben Wissenschaftler in einem in der Zeitschrift Nature Cell Biology veröffentlichten Artikel gezeigt, dass Fehler bei der Chromosomenverteilung die Form des Zellkerns sowie seine mechanischen Eigenschaften verändern. Die Form und Mechanik des Kerns werden bekanntermaßen durch interne Faktoren wie die Organisation des Chromatins (die Struktur, die die DNA enthält) und die Kernlamina (ein Netzwerk von Proteinen, das den Kern stützt) sowie durch externe mechanische Kräfte beeinflusst.
Diese Wechselwirkungen beeinträchtigen die Integrität des Genoms und die Zellfunktion. Die Wissenschaftler entdeckten, dass die durch Mitosefehler verursachte veränderte Kernform die Chromatinorganisation, die korrekte Assemblierung der Lamina und die Kernmechanik beeinflusst, was insgesamt die Kernsteifigkeit verringert und die Spannung der Kernhülle erhöht.
Die Form und Mechanik des Kerns werden durch die Organisation der DNA mit den assoziierten Proteinen (gemeinsam als Chromatin bezeichnet) innerhalb des Kerns sowie durch den Zustand des faserigen Proteinnetzwerks, das den Kern umgibt, die Kernlamina, beeinflusst.
„Wir waren überrascht, festzustellen, dass strukturelle Anomalien des Kerns ausreichten, um den p53-Kontrollpunkt auszulösen. Dies deutet darauf hin, dass die Zellen den Zustand der Chromatin-Kernlamina-Schnittstelle überwachen. Dieser Mechanismus fungiert als Kontrollpunkt und verhindert die Vermehrung aneuploider Zellen“, erklärt Yekaterina Miroshnikova, Seniorautorin der Studie.
Die Wissenschaftler identifizierten auch die molekularen Mechanismen, die diese mechanischen und strukturellen Anomalien des Kerns erkennen, und zeigten, dass chemische Inhibitoren, die diese Signalwege, insbesondere die mTOR- und ATR-Signalwege, gezielt angreifen, die Aktivierung von p53 verhindern können.
„Wichtig ist, dass wir festgestellt haben, dass dieser Überwachungsmechanismus in verschiedenen anderen Kontexten genutzt wird. Zum Beispiel wird er in Situationen aktiviert, die mit dem Altern zusammenhängen, wie bei einer Krankheit namens Progerie, die durch Symptome vorzeitiger Alterung bei Patienten und eine gestörte Assemblierung der Kernlamina auf zellulärer Ebene gekennzeichnet ist. Diese Ergebnisse unterstreichen die entscheidende Rolle der Erkennung mechanischer Kernanomalien in verschiedenen pathologischen Kontexten“, erklärt Daniele Fachinetti, Seniorautor der Studie.
Zusammenfassend beleuchten diese Ergebnisse, wie Zellen eine abnormale Chromatinorganisation und Chromosomenanomalien erkennen, einen schützenden Kontrollpunkt aktivieren und so die Vermehrung dysfunktionaler Zellen verhindern. Obwohl die Erkennung mechanischer Kernveränderungen die Vermehrung abnormaler Zellen einschränkt, können diese Veränderungen auch schädliche Auswirkungen haben.
Zum Beispiel zeigen die Wissenschaftler, dass eine erhöhte Flexibilität des Kerns die Fähigkeit aneuploider Zellen verbessert, sich zu verformen und in komplexe Umgebungen einzudringen, ein Prozess, der Metastasen begünstigen kann, insbesondere wenn der Kontrollpunkt durch p53-Mutationen umgangen wird, die in Krebserkrankungen häufig vorkommen.
Somit erweist sich die Kernmechanik als vielversprechender Ansatz, um pathologische Zellen im Kontext von Krebs und altersbedingten Erkrankungen besser zu erkennen und zu bekämpfen.
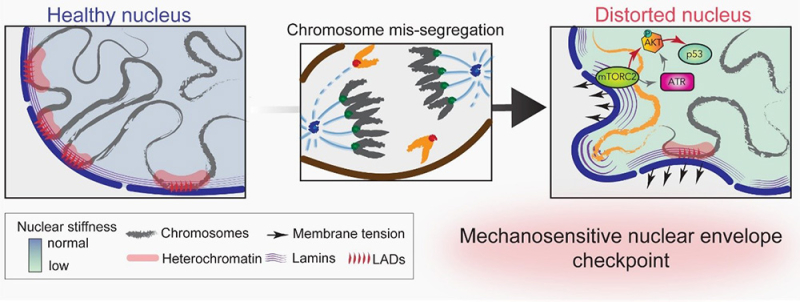
Ein mechanosensitiver Kernkontrollpunkt löst den Zellzyklusarrest nach fehlerhafter Chromosomenverteilung aus. Fehler bei der Chromosomenverteilung während der Mitose, zum Beispiel durch eine Dysfunktion des Zentromers verursacht (die roten Punkte stellen inaktive Zentromere dar), führen zu einer Verformung und Erweichung des Kerns, einer Verringerung des Heterochromatins an der Kernperipherie und Defekten in der Laminassemblierung. Diese Veränderungen erhöhen die Spannung auf die Kernhülle der Tochterzellen, was die Aktivierung der Mechanorezeptoren mTORC2 und ATR auslöst und einen p53- und p21-abhängigen Zellzyklusarrest bewirkt.
© Daniele Fachinetti
Referenz:
Hervé, S., Scelfo, A., Bersano Marchisio, G. et al. Chromosome mis-segregation triggers cell cycle arrest through a mechanosensitive nuclear envelope checkpoint.
Nat Cell Biol 27, 73-86 (2025). https://doi.org/10.1038/s41556-024-01565-x