Das Team zeigt, dass Schäden in nicht-kodierenden Abschnitten der DNA, die oft verborgen sind, sich in Geweben mit "geringer Zellproliferation" stärker ansammeln, wie in der Leber oder den Nieren. Im Gegensatz zu Organen, die sich häufig regenerieren, bleiben diese Schäden lange unbemerkt und behindern die Zellteilung. Diese Ergebnisse, die in der Zeitschrift Cell veröffentlicht wurden, eröffnen neue Wege, um die Zellalterung besser zu verstehen und möglicherweise zu verlangsamen.
Unsere Organe und Gewebe altern nicht alle mit der gleichen Geschwindigkeit. Die Alterung, gekennzeichnet durch die Zunahme seneszenter Zellen - Zellen, die sich nicht mehr teilen können und ihre Funktionen verloren haben -, betrifft die Leber oder die Nieren schneller als die Haut oder den Darm. Die Mechanismen, die zu diesem Prozess beitragen, sind in der wissenschaftlichen Gemeinschaft stark umstritten. Es wird weithin akzeptiert, dass DNA-Schäden, die mit zunehmendem Alter zunehmen, die Alterung verursachen, doch der Zusammenhang zwischen den beiden Phänomenen ist nicht vollständig aufgeklärt.
DNA-Moleküle enthalten kodierende Abschnitte - Gene, die für Proteine kodieren - und nicht-kodierende Abschnitte, die an der Regulation oder Organisation des Genoms beteiligt sind. Diese werden ständig durch äußere und innere Faktoren geschädigt, aber die Zellen haben Reparatursysteme, die die Ansammlung von Fehlern verhindern.
Die Schäden in den kodierenden Abschnitten werden während der Gen-Transkription, also ihrer Aktivierung, erkannt. Schäden in den nicht-kodierenden Abschnitten werden während der Zellregeneration aufgedeckt, da bei jeder neuen Zellteilung eine Kopie des Genoms durch den DNA-Replikationsprozess erstellt wird. Die Zellregeneration erfolgt jedoch je nach Gewebe- oder Organtyp mit unterschiedlicher Häufigkeit.
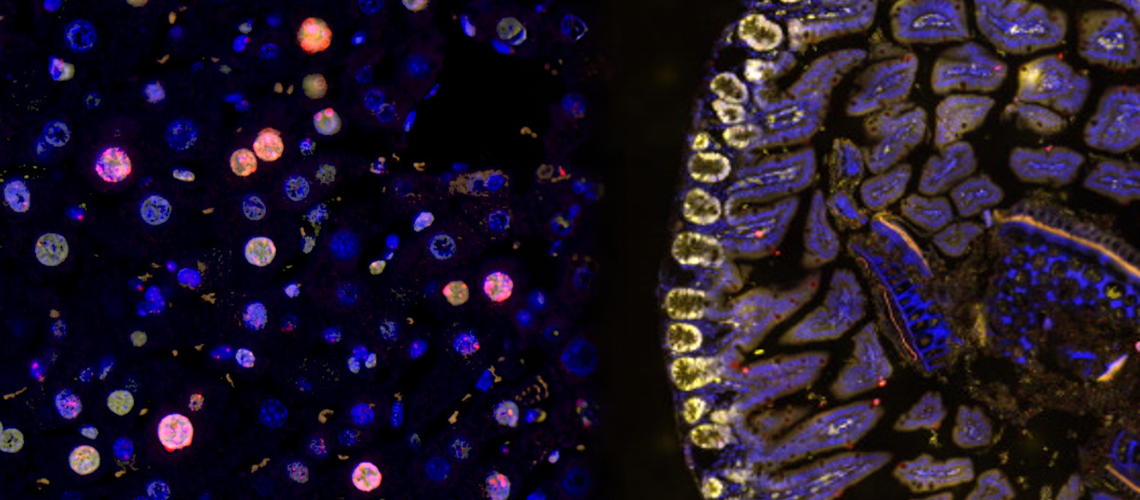
In Rot, links, Leberzellen mit beschädigter DNA. In Gelb, rechts, proliferierende Darmzellen, deren DNA nicht beschädigt ist, sind gelb gefärbt.
© UNIGE / UNIBE
Gewebe und Organe, die ständig mit der Außenwelt in Kontakt stehen und somit anfälliger für Schäden sind, wie die Haut oder der Darm, erneuern ihre Zellen (und replizieren somit ihre DNA) häufiger - ein- bis zweimal pro Woche - als innere Organe wie die Leber oder die Nieren, die durch den Kontakt mit der Außenwelt geschützt sind und ihre Zellen höchstens nur wenige Male im Jahr erneuern.
Die Leber, ein ideales Modell zur Erforschung der Alterung
Die Gruppe von Thanos Halazonetis, Professor am Département für Molekular- und Zellbiologie der Fakultät der Wissenschaften der UNIGE, untersucht die Mechanismen der DNA-Replikation. Sein Team, in Zusammenarbeit mit den Gruppen von Prof. Stroka und Prof. Candinas am Berner Inselspital und an der UNIBE, beschäftigte sich mit Leberzellen (Hepatozyten), die sich nur langsam vermehren und deren DNA selten repliziert wird. Die Wissenschaftler analysierten den möglichen Zusammenhang zwischen dem schnelleren Altern der Leber und der geringeren Häufigkeit der DNA-Replikation in ihren Zellen.
"Unser Studienmodell, die Leber der Maus, ist ein ideales Organ, um die DNA-Replikationsmechanismen in vivo zu untersuchen. Bei erwachsenen Säugetieren proliferieren Hepatozyten nicht mehr, es sei denn, es findet eine partielle Entfernung der Leber statt. Nach der Entfernung von zwei Dritteln der Leber bei jungen oder alten Mäusen können wir die Replikationsmechanismen in einem jungen oder alternden Organ, direkt im lebenden Organismus, untersuchen", erklärt Prof. Deborah Stroka, Co-Letztautorin der Studie.
Erstmals gelang es den Forschern, die Startpunkte der DNA-Replikation nach der Entfernung der Leber zu kartieren, und sie stellten fest, dass diese immer in nicht-kodierenden Regionen lokalisiert sind. Zudem wurde beobachtet, dass die Replikation bei jungen Mäusen viel effizienter ist als bei alten Mäusen.
"Diese nicht-kodierenden Regionen unterliegen keinem regelmäßigen Fehlerkontrollsystem, daher sammeln sie im Laufe der Zeit Schäden an. Nach der Entfernung der Leber bei jungen Mäusen sind die Schäden noch gering und die DNA kann repliziert werden. Wenn das Experiment jedoch bei alten Mäusen durchgeführt wird, löst die durch die Zeit angesammelte Vielzahl an Schäden ein Alarmsystem aus, das die DNA-Replikation verhindert", analysiert Giacomo Rossetti, Assistenzprofessor am Département für Molekular- und Zellbiologie der Fakultät der Wissenschaften der UNIGE und Erstautor der Studie.
Dieser Stopp der Replikation in den beschädigten DNA-Zellen verhindert die Zellproliferation und führt so zu einer Verschlechterung der Zellfunktionen und zur Seneszenz des Gewebes.
Hoffnung auf eine Verlangsamung der Alterung
Diese Beobachtungen könnten erklären, warum Gewebe mit langsamer Zellproliferation, wie die Leber, schneller altern als Gewebe mit schneller Zellproliferation, wie der Darm. In Zellen, die über lange Zeit inaktiv geblieben sind, haben sich zu viele kryptische DNA-Schäden in den nicht-kodierenden Regionen angesammelt, die unter anderem die Ursprünge der Replikation enthalten, und verhindern den Start der Replikation. In Geweben mit schneller Zellproliferation hingegen akkumulieren sich nur wenige Schäden dank der häufigen Zellteilung, und die Replikationsursprünge bleiben effizient.
"Unser Modell legt nahe, dass einige Aspekte der Alterung möglicherweise vermieden werden könnten, wenn man kryptische DNA-Schäden vor dem Start der Replikation reparieren würde. An dieser neuen Arbeitshypothese werden wir weiter arbeiten", schließt Thanos Halazonetis.