Diese Entdeckung stellt ein seit über 60 Jahren etabliertes theoretisches Modell in Frage und eröffnet neue Perspektiven für das Verständnis von neuroentwicklungsbedingten Störungen, die mit synaptischen Defiziten zusammenhängen.
Die Verbindungen zwischen den Neuronen, sogenannte Synapsen, sind die unverzichtbaren funktionellen Einheiten des Gehirns. Es gibt verschiedene Typen, die es ermöglichen, eine Vielzahl von Neuronen in komplexen und dennoch präzisen Schaltkreisen zu verbinden, die alle Gehirnfunktionen regulieren.
Im Jahr 1963 stellte Roger Sperry eine grundlegende Hypothese auf, die sogenannte "Chemoaffinität": Nach dieser Theorie würde jeder Synapsentyp durch eine einzigartige Kombination von Molekülen definiert, die während der Entstehung der Neuronen festgelegt wird. Obwohl jahrzehntelange Forschung viele Adhäsionsmoleküle identifiziert hat, die an der Bildung und Aufrechterhaltung verschiedener Synapsentypen beteiligt sind, wurde die Existenz spezifischer molekularer Kombinationen für jeden Verbindungstyp sowie ihre instruktive Rolle während der Entwicklung bisher nie nachgewiesen.
Eine neue Sicht auf die Entwicklung der Synapsenvielfalt
In einer Studie, die in Nature Neuroscience veröffentlicht wurde, haben Wissenschaftler einen unerwarteten Mechanismus der Synapsenentwicklung durch die Untersuchung des Kleinhirns aufgedeckt, einer Gehirnstruktur, die für die motorische Koordination verantwortlich ist und an vielen kognitiven Prozessen beteiligt ist.
In dieser Struktur erhalten die Purkinje-Zellen zwei Arten von erregenden Synapsen: die Synapsen der Kletterfasern und die der Parallelfasern. Obwohl diese beiden Verbindungstypen zunächst auf demselben Gebiet der Purkinje-Zelle entstehen, besetzen sie schließlich getrennte Gebiete und erlangen im reifen Zustand sehr unterschiedliche Eigenschaften. Durch die Kombination von Transkriptomik, Bioinformatik und genetischen Manipulationen bei Mäusen konnten die Wissenschaftler zunächst nachweisen, dass unterschiedliche Molekülkombinationen diese beiden Synapsentypen im reifen Netzwerk charakterisieren.
Im Gegensatz zu den Erwartungen zeigt die Studie jedoch, dass diese Kombinationen nicht vordefiniert sind, sondern sich sequenziell während der Entwicklung und Reifung des Netzwerks entwickeln.
Entwicklungsregeln, die für jeden Synapsentyp spezifisch sind
Überraschenderweise zeigen die Ergebnisse auch, dass die Synapsen der Kletterfasern und der Parallelfasern zunächst ein gemeinsames präsynaptisches Molekül verwenden, um ihre Verbindungen mit den Purkinje-Zellen herzustellen. Später entwickeln die Neuronen der Kletterfasern schrittweise eine spezifische molekulare Signatur, wodurch neue Adhäsionsmoleküle an ihren Synapsen freigesetzt werden, während die Verbindungen der Parallelfasern ihre ursprüngliche Identität beibehalten.
Diese Entdeckung erklärt, warum diese beiden Fasertypen zunächst dasselbe Gebiet auf den Purkinje-Zellen teilen, bevor sie sich in getrennte Gebiete aufteilen – eine Trennung, die direkt auf die Divergenz ihrer molekularen Codes zurückzuführen ist. Bemerkenswert ist, dass diese Codes teilweise durch sekretierte Moleküle und nicht durch "klassische" Adhäsionsmoleküle bestimmt werden.
Die Wissenschaftler konnten schließlich nachweisen, dass die elektrische Aktivität der Neuronen der Kletterfasern die molekulare Reifung ihrer eigenen Synapsen reguliert, was darauf hindeutet, dass externe Faktoren wie die sensomotorische Erfahrung bestimmte Arten von Nervenverbindungen während dieser frühen Entwicklungsphase spezifisch modulieren könnten.
Hin zu einem besseren Verständnis von neuroentwicklungsbedingten Störungen
Dieses neue Modell der sequenziellen Entwicklung neuronaler Verbindungen könnte auf andere Gehirnregionen anwendbar sein, in denen verschiedene Neuronen auf klar definierten Gebieten ihrer Zielzellen verbunden sind, ähnlich wie im Kleinhirn. Diese Hypothese wird durch die Präsenz der identifizierten Moleküle an den Kletter- und Parallelfasersynapsen im gesamten Gehirn gestützt, wo sie eine ähnliche Rolle bei der Kodierung der Synapsenidentität spielen könnten.
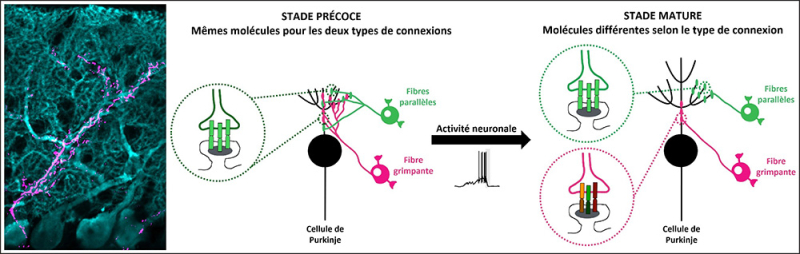
Links: Mikroskopische Aufnahme von Purkinje-Zellen (cyan) sowie einer Kletterfaser und ihren Synapsen (magenta).
Rechts: Diese Illustration zeigt die Entwicklung der beiden erregenden Verbindungstypen an den Purkinje-Zellen (schwarz) während der postnatalen Entwicklung bei Mäusen: die Synapsen der Kletterfasern (rosa) und der Parallelfasern (grün). Anfangs teilen sich diese beiden Synapsentypen dieselbe molekulare Identität und dasselbe Gebiet auf der wachsenden Purkinje-Zelle, bevor ihre Gebiete divergieren, wenn die Synapsen der Kletterfasern im reifen Zustand eine eigene Identität erlangen. Die neuronale Aktivität moduliert teilweise die molekulare Identität und das Gebiet der Kletterfasersynapsen.
© Maëla Paul, CIRB
Diese grundlegende Entdeckung eröffnet neue Perspektiven für das Verständnis der Komplexität der Gehirnschaltkreise und der Ursachen bestimmter Symptome bei Entwicklungsstörungen des Gehirns wie Autismus-Spektrum-Störungen oder Schizophrenie.
Referenz:
Paul MA*, Sigoillot SM* et al., Stepwise molecular specification of excitatory synapse diversity onto cerebellar Purkinje cells. Nature Neuroscience. Veröffentlicht online am 10. Dezember 2024. https://doi.org/10.1038/s41593-024-01826-w
* Gleichwertiger Beitrag.