Zoom sur les polyribosomes en hélice
Publié par Isabelle,
Source: CNRS/INSBAutres langues:
Source: CNRS/INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
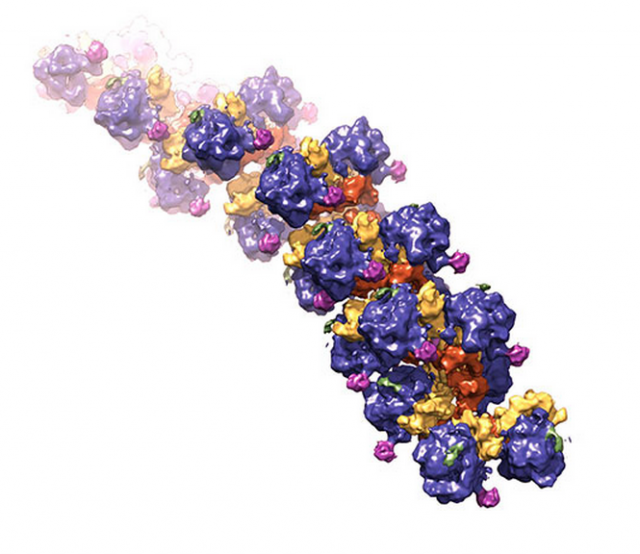
Ribosomes. Illustration: CNRS/INSB
La synthèse des protéines s'effectue en plusieurs étapes. Grâce à l'ARN polymérase, la molécule d'ADN est d'abord transcrite en ARN messager, lui-même traduit en protéine par les ribosomes. La microscopie électronique permet de visualiser toutes ces étapes et montre que les ribosomes s'assemblent parfois "comme des billes sur un collier" sur une même molécule d'ARN afin de traduire simultanément celle-ci et produire ainsi une grande quantité de protéines. On parle alors de "polyribosome". Toutefois, jusqu'à présent cette technique ne permettait qu'une observation en 2 dimensions, montrant à fort grossissement une structure en zigzag dont la signification restait obscure, alors qu'elle avait été observée dans des cellules il y a déjà plus de 40 ans.
Dans cette nouvelle étude, les chercheurs sont parvenus à déterminer la structure tridimensionnelle complète d'un assemblage de 100 MDa comprenant pas moins de 23 ribosomes sur une même molécule d'ARN messager. Ceci est devenu possible grâce à la cryotomographie électronique au cours de laquelle l'objet est observé sous différents angles avant d'être reconstitué en 3D par informatique. Couplée aux connaissances structurales en cristallographie sur le ribosome seul, ces nouvelles données ont permis de déterminer avec beaucoup de précision la structure en 3 dimensions du polyribosome et des différentes interactions entre ribosomes qu'elle implique, visualisant ainsi en 3D les régions de démarrage, production et fin de la synthèse protéique. Les chercheurs ont notamment montré que les ribosomes s'assemblent sous forme d'une hélice gauche et forment un canal continu dans lequel se loge la molécule d'ARNm. Séparés d'une quarantaine de nucléotides, les ribosomes se positionnent selon une orientation précise, la petite sous-unité (40S) vers l'intérieur, et la grande (60S), qui permet la sortie de la protéine synthétisée, vers l'extérieur. Dans cette structure très compacte, les interactions entre les ribosomes sont nombreuses (30% de leur surface), ce qui renforce la stabilité de l'hélice.
Cette structure très dense pose la question de l'encombrement et grâce à des études cinétiques, les chercheurs ont également montré que l'efficacité de la traduction était optimale avec 8 ribosomes sur une même molécule d'ARNm. Une surcharge en ribosomes pourrait permettre de mettre en suspens la synthèse, avec la possibilité de réactiver celle-ci très rapidement en cas de besoin, comme par exemple dans des synapses de cellules neuronales.
Au-delà des aspects structuraux, les chercheurs ont observé que les ribosomes actifs étaient globalement tous dans le même état au niveau du processus de traduction. Cette homogénéité soulève l'hypothèse d'une coopération entre les ribosomes qui seraient en mesure de collaborer afin de mieux se synchroniser.
Ces résultats apportent un nouveau regard sur les machineries moléculaire du ribosome arrangées en chaine sur l'ARN messager, et élargissent une nouvelle fois les connaissances sur le processus vital et particulièrement complexe de la synthèse protéique.

Légende de l'image
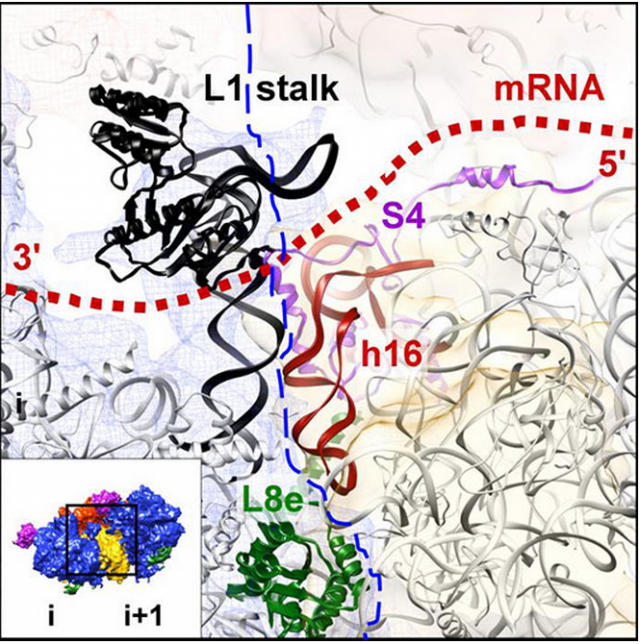
Ribosome i en tête <- <- -> -> ribosome i+1 suivant
En bas, détail des interactions protéiques entre le site de sortie de l'ARNm au niveau d'un ribosome (i), et le site d'entrée de l'ARNm au niveau du ribosome suivant (i+1). Ces détails montrent bien une continuité du canal qui contient l'ARNm (pointillés en rouge), passant d'un ribosome à l'autre sans faire de boucle, ce qui lui permet d'être protégé à l'intérieur.
© Bruno Klaholz
Pour plus d'information voir: The molecular structure of the left-handed supra-molecular helix of eukaryotic polyribosomes.