Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
La compréhension des mécanismes de la signalisation biochimique, omniprésente dans le réseau vasculaire, est essentielle pour la conception de thérapies adaptées aux pathologies cardiovasculaires. La libération de l'ATP (Adénosine Triphosphate) par les globules rouges est un mécanisme majeur qui a été modélisé dans ce travail, en accord avec des expériences réalisées à Harvard.
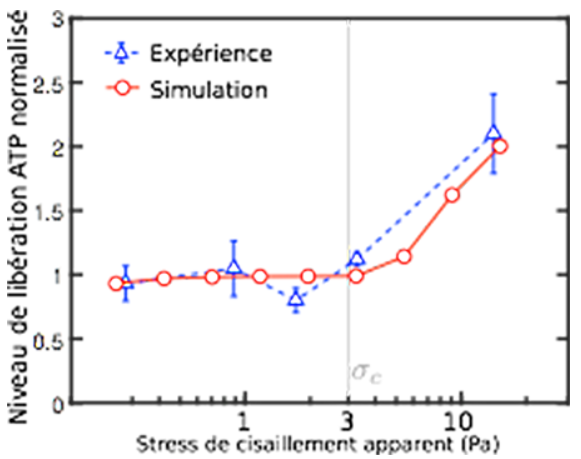
Figure 1: Taux d'ATP en fonction de la contrainte hydrodynamique appliquée
Le réseau vasculaire est un siège fascinant de signalisation biochimique, dans lequel participent différents types de cellules, tels les globules rouges, globules blancs, et les cellules endothéliales (qui tapissent les faces internes des vaisseaux sanguins). Une altération de cette signalisation est à l'origine de multiples dysfonctionnements menant à des pathologies. Une compréhension fine de ce problème nécessite une modélisation et simulation complexe mettant en jeu l'écoulement sanguin, son interaction avec l'endothélium et les réactions et transport des éléments biochimiques mis en jeu. Une telle modélisation est longtemps restée comme un défi majeur que des chercheurs du Laboratoire interdisciplinaire de physique (LIPhy, CNRS/Université Grenoble Alpes), en collaboration avec le Laboratoire ondes et matière d'Aquitaine (LOMA, CNRS/Université Bordeaux) et le Laboratoire d'hydrodynamique de l'École Polytechnique (LadHyX, CNRS/X) viennent de relever. Pour illustrer leur travail, les chercheurs ont pris comme exemple la libération de l'ATP – la source majeure d'énergie de l'organisme – par les globules rouges.
Les globules rouges sont communément connus comme des cargos d'oxygène. En réalité, ils transportent également l'ATP. Par exemple, en cas de manque d'oxygène, l'ATP est libérée par les globules rouges pour entrainer une vasodilatation et donc augmenter le flux sanguin. Une chute de libération d'ATP par les globules rouges est associée à des pathologies comme le diabète de type II et la fibrose kystique (maladie génétique qui touche principalement les poumons et le système digestif). La libération de l'ATP par les globules rouges est un processus impliquant un changement de conformation de protéines membranaires et la modélisation des mécanismes mis en jeu est longtemps restée un grand défi pour les scientifiques.
Dans ce travail, les chercheurs ont proposé un modèle de libération qui met en jeu deux mécanismes. Le premier consiste en l'existence d'un seuil en contraintes hydrodynamiques dû à l'écoulement sanguin ressenti par les globules rouges, qui induit un changement de conformation d'une protéine membranaire permettant la libération locale de l'ATP. Le second mécanisme est relié à la déformation des globules rouges. Si la courbure membranaire de ceux-ci dépasse une valeur critique, des défauts sont créés dans le réseau d'actine sous-jacent, lesquels s'agrègent sur une autre protéine stimulant à son tour la libération de l'ATP. En proposant ce modèle et en le résolvant numériquement par la méthode "Boltzmann sur réseau", un bel accord est obtenu entre le modèle et des résultats issus d'expériences récentes in vitro réalisées à l'Université de Harvard (Fig.1). De plus, cette étude met en lumière le rôle important joué par les bifurcations du réseau vasculaire qui amplifient fortement la libération de l'ATP (Fig. 2).
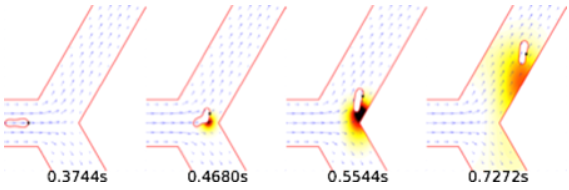
Figure 2: Un globule rouge montrant une grande amplification de la libération d'ATP (couleur foncée) au niveau de la bifurcation
Ce travail ouvre de nombreuses perspectives pour la simulation systématique mettant en jeu les écoulements sanguins et la signalisation biochimique dans les réseaux vasculaires. Il devrait contribuer à comprendre comment la signalisation biochimique est impliquée dans des pathologies cardiovasculaires. Par exemple, il peut élucider la question de comment la distribution de l'ATP est altérée dans les réseaux vasculaires de patients atteints de diabète, et par là même de mieux guider les recherches en vue de la mise au point de thérapies appropriées.
Référence publication:
ATP Release by Red Blood Cells Under Flow: Model and Simulations
Hengdi Zhang, Zaiyi Shen, Brenna Hogan, Abdul I. Barakat et Chaouqi Misbah
Biophysical Journal, (2018)
DOI: 10.1016/j.bpj.2018.09.033
Contact chercheur:
Chaouqi Misbah, directeur de recherche au CNRS
Informations complémentaires:
Laboratoire interdisciplinaire de physique (LIPhy, CNRS/Univ. Grenoble Alpes)
Laboratoire ondes et matière d'Aquitaine (LOMA, CNRS/Univ. Bordeaux)
Laboratoire d'hydrodynamique de l'École Polytechynique (LadHyX, CNRS/X)
Populaires