Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Comment réduire les populations de moustiques sans impacter l'environnement, ni induire de résistance ? Ce double défi est réussi par la bactérie Bacillus thuringiensis israelensis (Bti) qui produit, sous la forme de nanocristaux, quatre toxines ultra-spécifiques des larves de moustiques. Mais de la bactérie au moustique, comment se déroule la bio-activation de Cyt1Aa, celle des quatre toxines qui explique l'absence de résistance à Bti ? La détermination de sa structure tri-dimensionnelle à partir des nanocristaux naturels répond à cette question. Ces résultats sont publiés dans la revue Nature Communications.
Le moustique demeure l'organisme le plus néfaste à la santé humaine, transmettant virus, bactéries et parasites responsables de maladies ravageuses telles que le paludisme, la dengue ou encore le chikungunya. Pour réduire les populations de moustiques, la plupart des pays utilisent des insecticides chimiques, mais ces molécules entraînent la sélection de moustiques résistants et sont aussi toxiques pour les abeilles, les crustacés et les poissons.
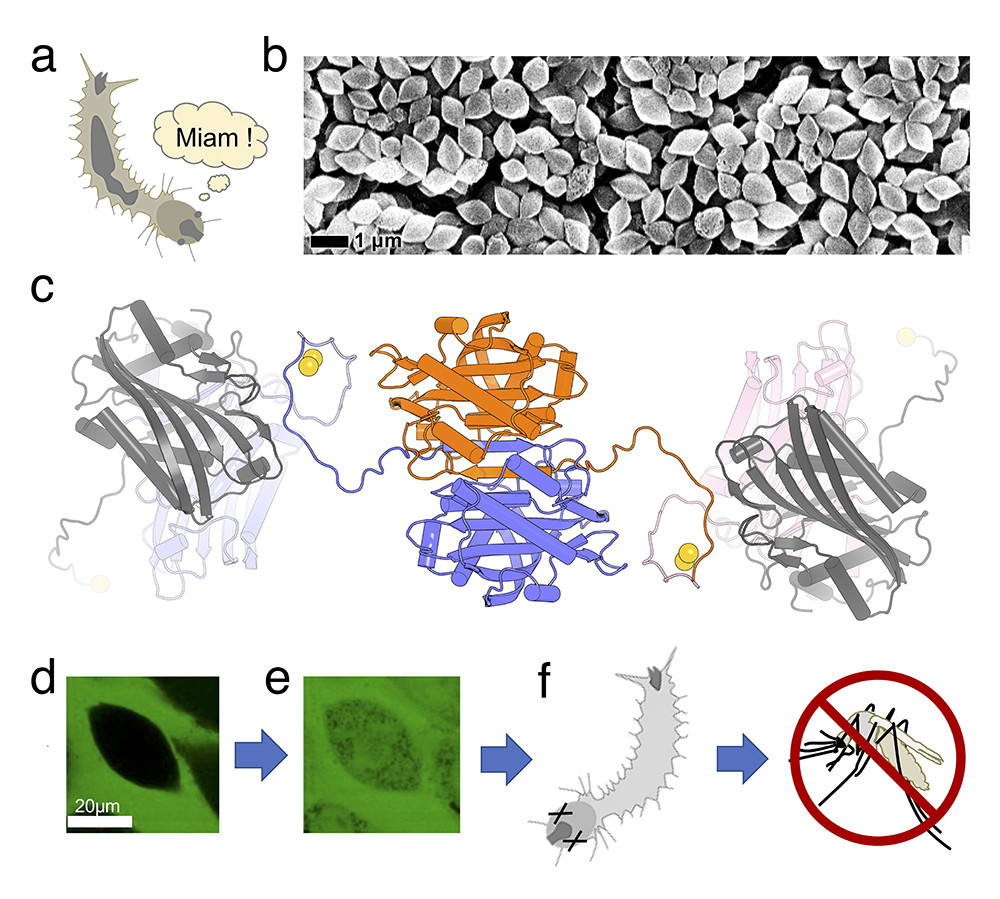
Cyt1Aa, une toxine anti-moustique naturelle.
a, Les larves de moustiques sont friandes de bactéries.
b, La bactérie Bacillus thuringiensis israelensis (Bti) produit quatres toxines spécifiques sous la forme de nanocristaux, dont Cyt1Aa.
c, La structure de Cyt1Aa, résolue à 1.8 Å de résolution à partir des nanocristaux naturels mesurant moins de 1 µm dans leur dimension la plus large, a révélé que ceux-ci se forment par chaînage, via des ponts disulfures, de dimères à domaines échangés de Cyt1Aa.
d-e, Les pores formés par Cyt1Aa dans les membranes cellulaires (ici des cellules d'insectes SF21) sont si larges qu'ils permettent l'entrée, au sein des cellules, de billes de dextran fonctionnalisées à la fluorescéine larges de 8.5 nm.
f, C'est ainsi que les larves sont éliminées, évitant l'apparition des moustiques adultes.
© Jacques-Philippe Colletier.
Une approche alternative, respectueuse de l'environnement, consiste en l'épandage de spores de la bactérie Bacillus thuringiensis israelensis (Bti) dans les sites de reproduction des moustiques. Sous la forme de nanocristaux naturels, Bti produit un cocktail de quatre toxines ultra-spécifiques - Cyt1Aa, Cry11Aa, Cry4Aa et Cry4Ba. Suite à l'ingestion des spores par les larves de moustiques, les cristaux se dissolvent dans leur intestin sous l'effet de l'élévation du pH (jusqu'à 11), puis les protoxines solubles sont activées par des protéases (suppression des propeptides) et oligomérisent dans les membranes des cellules intestinales, entraînant leur perforation.
Des quatre toxines, Cyt1Aa est la seule capable d'interagir directement avec les membranes des cellules intestinales de moustiques, se liant aux lipides plutôt qu'à un récepteur protéique ancré dans celles-ci. Outre son activité propre, Cyt1Aa peut donc faciliter le maintien de l'activité des autres toxines dans le cas où apparaitrait une résistance basée sur la modification des récepteurs propres de ces dernières. Cette particularité de Cyt1Aa explique qu'aucune résistance n'ait à ce jour été observée dans les zones traitées au Bti et que Bti soit utilisé pour contrôler les populations de moustiques dans de nombreux pays (États-Unis, Allemagne, Thaïlande, Chine,...). Les coûts restent cependant élevés, rendant difficile une application dans les pays en voie de développement. Pour réduire ces coûts et permettre une utilisation plus large de cet anti-moustique naturel, augmenter son activité ou étendre son spectre d'action, une compréhension fine des mécanismes (i) de cristallisation in vivo au sein de Bti; (ii) de dissolution du cristal et d'activation des protoxines dans le tractus digestif de la larve ; et (iii) de toxicité est requise, notamment concernant Cyt1Aa.
C'est donc à la compréhension de ces trois mécanismes que se sont spécifiquement intéressés les chercheurs dans le cadre d'une collaboration internationale..La première gageure était de réussir à résoudre la structure de cette protéine dans le contexte naturel, i.e. à partir des nanocristaux formés au sein de Bti. Mesurant moins de 1 µm, ces cristaux sont en effet trop petits pour permettre la détermination d'une structure à résolution atomique par cristallographie d'oscillation dans un synchrotron - et ce, même à température cryogénique. Ainsi, les chercheurs ont eu recours à une source de rayons X démesurément plus puissante, un laser à électron libre X ou XFEL, capable de délivrer en un temps ultra court - quelques femtosecondes i.e. 10^-15 s - autant de rayons X qu'un synchrotron en une seconde. Grâce à cette installation et par cristallographie sérielle à l'échelle de la femtoseconde (ou SFX), ils ont pu résoudre à 1.8 Å de résolution la structure de Cyt1Aa à température ambiante, révélant les bases moléculaires de sa cristallisation in vivo et fournissant des indications sur le possible mécanisme de dissolution du cristal à haut pH, dans l'intestin de larves de moustiques.
Par mutagénèse dirigée et en faisant appel à une large gamme de méthodes biochimiques, biophysiques et toxicologiques, le consortium a pu identifier les interfaces centrales au mécanisme de dissolution et à l'activation de la protéine. Enfin, il a caractérisé les deux types d'oligomères pouvant se former en suite de l'interaction de Cyt1Aa avec la membrane, rationnalisant pour la première fois que cette seule protéine puisse à la fois exercer une toxicité directe (oligomères poreux) et synergiser celle des autres toxines (oligomères de surface).
En réconciliant des données jusqu'ici mises en avant pour opposer deux modèles, l'ensemble des résultats met fin à une trentaine d'années de controverses sur le fonctionnement de Cyt1Aa. Ils montrent par ailleurs que la taille, l'aspect, la toxicité et la sensibilité au pH des cristaux de Cyt1Aa peuvent être contrôlés par le remplacement d'un atome unique à une interface stratégique, dans une protéine de ~2700 atomes. Ces découvertes ouvrent la voie au perfectionnement rationnel des toxines de Bti, avec pour perspectives d'étendre le spectre d'action, d'augmenter la toxicité et de réduire les coûts, autorisant enfin une utilisation large de cet anti-moustique naturel.
Pour en savoir plus
Serial femtosecond crystallography on in vivo-grown crystals drives elucidation of mosquitocidal Cyt1Aa bioactivation cascade.Tetreau G, Banneville AS, Andreeva EA, Brewster AS, Hunter MS, Sierra RG, Teulon JM, Young ID, Burke N, Grünewald TA, Beaudouin J, Snigireva I, Fernandez-Luna MT, Burt A, Park HW, Signor L, Bafna JA, Sadir R, Fenel D, Boeri-Erba E, Bacia M, Zala N, Laporte F, Després L, Weik M, Boutet S, Rosenthal M, Coquelle N, Burghammer M, Cascio D, Sawaya MR, Winterhalter M, Gratton E, Gutsche I, Federici B, Pellequer JL, Sauter NK, Colletier JP.
Nat Commun. 2020 Mar 2;11(1):1153.
doi: 10.1038/s41467-020-14894-w.
Laboratoire
Institut de Biologie Structurale (IBS) - (CNRS/CEA/Univ. Grenoble Alpes)71, Avenue des Martyrs CS 10090 38044 Grenoble Cedex 9 (France)
Populaires