Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

Il a été démontré depuis plusieurs années que la séparation de phases liquide-liquide, induite par de faibles interactions faisant souvent intervenir des protéines intrinsèquement désordonnées ou de l'ARN, offre un moyen très efficace de contrôler spatialement et temporellement les processus cellulaires. Les propriétés physicochimiques de ces micro-environnements fournissent des conditions optimales permettant d'améliorer des interactions moléculaires spécifiques, non seulement en protégeant les molécules de leur environnement, mais également sans la nécessité de former des membranes. Les bases moléculaires de la stabilisation de ces micro-environnements restent peu comprises. Les chercheurs de l'Irig ont caractérisé la façon dont ces processus sont utilisés par les protéines du virus de la rougeole.
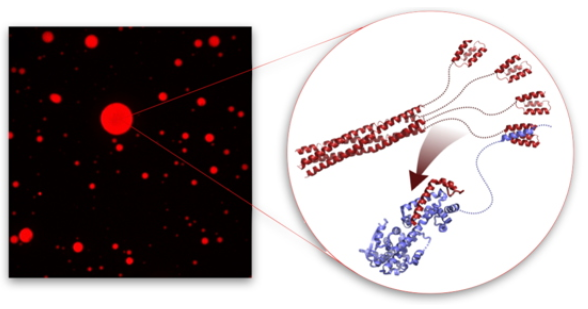
De nombreux virus forment des compartiments dans les cellules qu'ils infectent. Dans cette étude, des chercheurs de notre institut montrent que lorsque les nucléo-protéines (N) et les phospho-protéines (P) du virus de la rougeole sont mélangées in vitro, elles forment des organites liquides sans membrane, telles des gouttelettes d'huile dans l'eau. Pour appréhender ce processus, ils utilisent la résonance magnétique nucléaire (RMN) afin d'identifier les interactions faibles impliquant des domaines intrinsèquement désordonnés de N et de P et montrent que l'une de ces interactions s'avère être essentielle à la séparation des phases. Les chercheurs suivent la modulation de la dynamique de N et P lors de la formation des gouttelettes par fluorescence, et étudient la thermodynamique de ce processus par RMN.
Ils observent ainsi que lorsque de l'ARN est ajouté à une suspension de gouttelettes, il se localise dans celles-ci où il induit une étape essentielle du cycle de réplication du virus: l'assemblage des nucléocapsides virales. Ils mesurent d'autre part que la vitesse à laquelle cet assemblage a lieu dans ces gouttelettes est plus élevée que dans la phase diluée. À la suite de ces travaux, ils sont alors en mesure de comprendre pourquoi les virus forment ces gouttelettes dans les cellules infectées. Les virus les fabriqueraient pour créer de véritables usines éphémères et transitoires, où ils synthétisent à grande vitesse des nucléocapsides qui assurent leur réplication, dans un environnement favorable et protégé.
Cette étude révèle que la réplication virale pourrait être diminuée en inhibant la formation de gouttelettes, et que la formation de ces phases pourrait représenter une cible pharmacologique nouvelle pour lutter contre ces virus.
Note:
Les protéines intrinsèquement désordonnées sont dépourvues de structure tridimensionnelle stable et sont fonctionnelles dans leur état désordonné. Leur grande flexibilité leur permet de s'adapter facilement à la surface de leurs partenaires et sont capables de se replier lors d'une interaction.
Cette étape essentielle est l'assemblage des protomères N en particules de type nucléocapside qui encapsident les molécules d'ARN.
Références:
Guseva S, Milles S, Jensen MR, Salvi N, Kleman JP, Maurin D, Ruigrok RWH and Blackledge M. Measles virus nucleo- and phosphoproteins form liquid-like phase-separated compartments that promote nucleocapsid assembly. Science Advances, 2020