Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les capteurs à magnétorésistance géante (GMR) [1] qui se sont développés dans une grande variété d'applications spintroniques (industrie automobile, informatique etc.), présentent également un réel potentiel dans le domaine de la santé, notamment pour le développement de dispositifs de diagnostic précoce sur les lieux de soins. Le principe de détection de cette technique repose sur l'utilisation de particules magnétiques fonctionnalisées par des anticorps monoclonaux, produits au Laboratoire d'Etudes et de Recherches en Immunoanalyse (CEA-Saclay/LERI), dirigés contre la cible d'intérêt (figure 1A). La détection dynamique de celle-ci, après interaction avec les particules magnétiques, est réalisée à l'aide des capteurs GMR, développés au Laboratoire Nano-magnétisme et Oxydes (CEA-Saclay/LNO), qui permettent de compter un par un les objets biologiques magnétiquement ciblés. De plus, les mesures peuvent être effectuées avec des matrices complexes, même opaques, et des cibles biologiques de nature éventuellement différentes (cellules, bactéries etc.) peuvent être détectées sans aucune étape de lavage préalable et même à faible concentration.

A: Marquage des cellules avec des Dynabeads MyOne magnétiques de 1 μm. Étape 1: Couplage des Dynabeads MyOne Streptavidin T1 avec des anticorps biotinylés Étape 2: Saturation et stockage des billes fonctionnalisées dans du PBS 0,1% BSA. Etape 3: Marquage magnétique des cellules avec les billes fonctionnalisées.
B: Protocole expérimental réalisé avec un contrôle négatif (à gauche) composé de billes marquées à l'anticorps anti-CD138 seules et un test spécifique (à droite) avec des billes magnétiques fonctionnalisées avec des anticorps anti-CD138 en présence de cellules cibles NS1.
Afin de marquer correctement les objets biologiques, il est nécessaire d'introduire des billes magnétiques en excès. Dans le mélange, on trouve donc trois types d'objets magnétiques, les cibles biologiques marquées, les billes individuelles surnuméraires et d'éventuels agrégats de billes. La plupart des objets biologiques ont un signal magnétique bien plus grand que celui des billes ou des agrégats. Cependant, comme le champ dipolaire émis par un objet magnétique et détecté par le capteur GMR s'écrit.
Où µ est le moment magnétique de l'objet et z sa hauteur de passage dans le canal microfluidique. On constate que dans le cas d'une biopuce ne possédant qu'une seule série de capteurs sous le canal microfluidique (dispositif standard) [2] un agrégat ou une bille qui passe dans le bas du canal, tout près du capteur GMR, peut donner un signal équivalent à celui d'un objet biologique magnétiquement marqué par plusieurs billes mais passant plus haut, loin du capteur. Ceci engendre un certain nombre de faux positifs parmi les signaux détectés. Ainsi pour résoudre ce problème, nous avons développé et brevetée [3] une nouvelle biopuce (appelée capteurs 2 étages) avec des capteurs GMR disposés face à face de part et d'autre du canal microfluidique qui permet la détection simultanée des objets magnétiques (figure 1a). Les signaux émis par un même objet magnétique lors de son passage dans le canal sur un capteur haut et un capteur bas parfaitement alignés, forment ce que nous avons appelé "une coïncidence. D'après l'équation 1, on voit qu'en calculant le rapport des amplitudes des signaux constituant cette coïncidence, il est possible de déterminer la hauteur z de passage de l'objet puis son moment magnétique (proportionnel au nombre de billes magnétiques contenues par l'objet).
Afin de réaliser la validation de cette technique, un modèle biologique simple, non pathogène et facilement manipulable a été choisi: des cellules eucaryotes de myélome murin, NS1 qui font un diamètre d'environ 7µm. Les études préliminaires ont montré qu'on pouvait les marquer magnétiquement avec une cinquantaine de billes commerciales d'1µm fonctionnalisées par des anticorps (anti-CD138) spécifiquement dirigés contre un récepteur (CD138) présent à la surface de cellules NS1. Nous avons préparé et analysé deux échantillons: un échantillon spécifique contenant 7 × 103 cellules NS1/ mL en présence de 1,5 × 107 par mL de billes magnétiques, en m fonctionnalisées avec l'anticorps spécifique anti-CD138 et un contrôle négatif ne contenant que les billes, en même quantité et fonctionnalisées avec le même anticorps spécifique anti-CD138 (figure 1B)
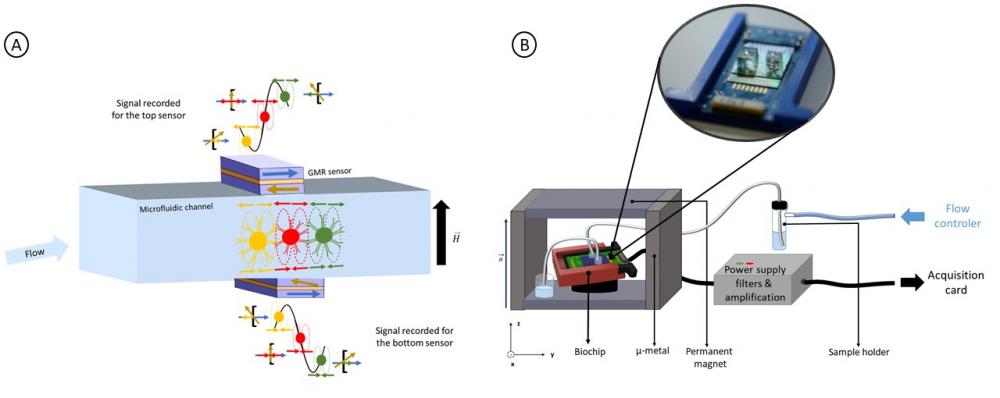
Figure 2
A: Principe de fonctionnement de la "biopuce deux étages"
B: Schéma du dispositif expérimental.
Pour la première fois, grâce à cette technique innovante de double détection GMR, il est possible de déterminer la hauteur de passage (figure 3A) dans le canal microfluidique et le moment magnétique des objets détectés (figure 3B), donc de différencier les signaux spécifiques issus des objets biologiques labélisées des faux-positifs provenant d'agrégats de billes [4]. Une étude complète, en cours d'écriture, sur ce modèle biologique cellulaire a montré qu'on peut ainsi gagner presque un facteur 100 sur la sensibilité. Cette nouvelle biopuce, qui permet ainsi l'identification des cibles biologiques à faible concentration, possède donc un grand potentiel pour du diagnostic précoce. Le dispositif actuel est en outre peu encombrant et donc transportable. Une nouvelle étude sur des bactéries, labélisées par des nanoparticules magnétiques ayant une grande stabilité colloïdale, spécialement conçues par le LITEN pour ce projet, est en cours.
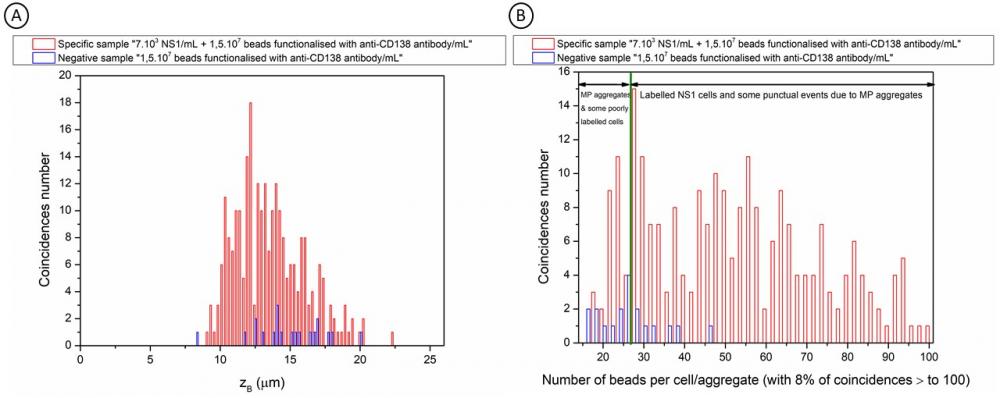
Figure 3
A: Comparaison du nombre de coïncidences en fonction de leur hauteur d'écoulement dans le canal microfluidique pour l'échantillon spécifique contenant des billes Dynabeads MyOne fonctionnalisées avec l'anticorps anti-CD138 en présence de 7.103 cellules NS1/mL (rouge) et l'échantillon négatif contenant uniquement des billes Dynabeads MyOne fonctionnalisées avec l'anticorps anti-CD138 (bleu).
B: Comparaison du nombre de billes par coïncidence pour l'échantillon spécifique contenant des billes Dynabeads MyOne fonctionnalisées avec l'anticorps anti-CD138 en présence de 7.103 cellules NS1/mL (rouge) et l'échantillon négatif contenant uniquement des billes Dynabeads MyOne fonctionnalisées avec l'anticorps anti-CD138 (bleu).
Bibliographie:
[1] Femtotesla magnetic field measurement with magnetoresistive sensors,Pannetier M., Fermon Claude, Le GoffG., Simola J et al, Science, Vol 304, (2004), p 1648-p 1650.
[2] Evaluation of In-Flow Magnetoresistive Chip Cell-Counter as a Diagnostic Tool, M. Giraud, F. D. Delapierre, A. Wijkhuisen, P. Bonville, M. Thevenin, G. Cannies, M. Plaisance, E. Paul, E. Ezan, S. Simon, C. Fermon, C.Feraudet-Tarisse and G,. JasminLebras, Biosensors, 2019, 9, 105 http://dx.doi.org/10.3390/bios903010
[3]Brevet Français n° 1855217 (étendu par voie internationale) C. Fermon, M. Giraud, F.D. Delapierre, G. Jasmin. 'Dispositif et procédé de détection magnétique d'objets biologiques microscopiques'
[4] Proof of concept of a two-stage GMR sensor based lab-on-a-chip for early diagnostic tests Maïkane Deroo Manon Giraud, François-Damien Delapierre,a Pierre Bonville,a Mathieu Jeckelmann,a Aurélie Solignac, Elodie Fabre-Paul, Mathieu Thévenin, Frédéric Coneggo, Claude Fermon, Florent Malloggi, Stéphanie Simon, Cécile Féraudet-Tarisse and Guénaëlle Jasmin-Lebras, Lab on a Chip (2022) doi: 10.1039/d2lc00353h (online a head of print) https://pubs.rsc.org/en/content/articlepdf/2022/lc/d2lc00353h