Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Staphylococcus aureus est un agent pathogène opportuniste majeur de l'homme, responsable d'une grande variété d'infections, allant des infections superficielles aux infections profondes avec une mortalité élevée. Au cours de la réaction immunitaire, les phagocytes (neutrophiles et macrophages) représentent la première ligne de défense de l'hôte et sont des composants importants de l'immunité innée contre S. aureus. Après la migration vers le site de l'infection, les cellules immunitaires déploient un arsenal de stratégies offensives avec notamment, la synthèse d'effecteurs antimicrobiens, tels que les espèces réactives de l'oxygène (ROS), qui peuvent endommager les acides nucléiques, les protéines et les lipides des bactéries. Les neutrophiles sécrètent également localement la calprotectine pour séquestrer les ions essentiels à la croissance bactérienne tels que le manganèse (Mn2+) et le zinc (Zn2+).
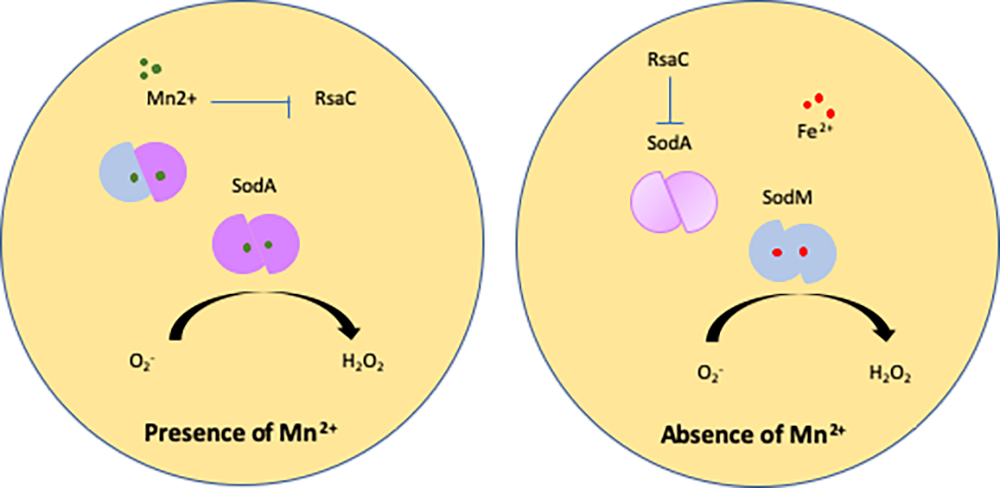
Figure: L'ARN régulateur RsaC module la réponse au stress oxydatif au cours de la carence en Mn. SodA est une superoxyde dismutase dépendante du Mn2+ qui est cruciale pour la réponse au stress oxydatif généré par la respiration aérobie ou par les cellules du système immunitaire. En l'absence de Mn2+, la transcription de RsaC est induite et cela régule négativement la traduction de l'ARNm sodA évitant la synthèse d'une enzyme non fonctionnelle. SodM, une superoxyde dismutase alternative utilisant les ions Fe2+ comme co-facteur, remplace SodA pour rétablir la voie de détoxification des ROS.
© Karen Moreau & Isabelle Caldelari
Pour contrecarrer les défenses immunitaires et coloniser de nombreux organes, S. aureus produit une vaste gamme de facteurs de virulence et de protéines de réponse au stress tels que les superoxyde dismutases (SOD) qui transforment les ROS en H2O2. Chez S. aureus, deux SOD sont impliquées dans la réponse oxydative. L'enzyme SOD majeure SodA dépend strictement du Mn2+, tandis que l'enzyme alternative SodM est active lorsqu'elle est chargée en Mn2+ ou en Fe2+.
Dans cette étude, les chercheurs ont montré que RsaC, un long ARN conservé dans toutes les souches de S. aureus est capable de réprimer la traduction de l'ARN messager (ARNm) sodA en absence de manganèse, évitant ainsi la synthèse inutile d'une enzyme non fonctionnelle. Parallèlement, RsaC améliore indirectement la réponse au stress oxydatif en favorisant la formation d'homodimères SodM, acteurs clés de la voie de détoxication alternative des ROS, et utilisant le Fer comme cofacteur. De manière remarquable, sodM et RsaC sont quasi exclusivement retrouvés chez les souches de S. aureus et leur confère potentiellement un avantage sélectif par rapport aux autres staphylocoques au cours de l'infection.
RsaC, co-transcrit avec l'opéron des gènes codant le transporteur du manganèse MntABC, est réprimé en présence de manganèse. RsaC fait donc le lien direct entre l'immunité nutritionnelle (i.e. absence de Mn2+) et la réponse au stress oxydatif, deux situations rencontrées sur les sites d'infection. L'ARN régulateur est maturé et stabilisé à partir de l'ARNm mntABC-RsaC après clivage par l'endoribonucléase III (RNase III). Ainsi, RsaC est le premier exemple d'ARN régulateur dérivé d'une séquence 3' non traduite d'un ARNm chez S. aureus.
Pour en savoir plus
RsaC sRNA modulates the oxidative stress response of Staphylococcus aureus during manganese starvation.
Lalaouna D, Baude J, Wu Z, Tomasini A, Chicher J, Marzi S, Vandenesch F, Romby P, Caldelari I, Moreau K.
Nucleic Acids Res. 2019 Oct 10;47(18):9871-9887. DOI: 10.1093/nar/gkz728.