La lumière ultraviolette de basse énergie altère les télomères de l'ADN
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Identification d'un nouveau mécanisme d'endommagement de l'ADN de nos cellules par du rayonnement UV de basse énergie.
Les télomères*, régions de l'ADN situées sur les extrémités des chromosomes, jouent un rôle important dans la division cellulaire, la cancérogénèse et le vieillissement. Leur fonction biologique peut être perturbée par des dommages oxydatifs, que l' on pensait uniquement provoqués par l'interaction de l'ADN avec d'autres molécules (issues du métabolisme ou reliées à la pollution et la prise des médicaments) agissant comme oxydants.
Dans le cadre du projet ANR OPHID coordonnée par le LIDYL, et d'une Chaire d'Alembert (IDEX – Univ. Paris-Saclay) attribuée à R. Improta (accueilli au LIDYL), il est montré que la lumière ultraviolette de basse énergie, absorbée directement par de l'ADN télomérique, génére des radicaux conduisant à des dommages oxydatifs [1].
La perte d'un électron sur l'une des bases d'une chaine ADN génère des radicaux à l'origine de dommages qualifiés "d'oxydatifs". Un tel effet se produit typiquement par des réactions d'oxydoréduction, mais aussi suite à l'absorption d'un photon ionisant, pourvu que son énergie soit supérieure au potentiel d'ionisation des bases, qui constituent l'alphabet du code génétique: λ < 200 nm, E > 6 eV: photons UV et au-delà. Une étude récente montre que ce seuil doit être considérablement abaissé, puisqu'elle met en évidence la formation d'un marqueur (8-oxo-guanine) bien connu des dommages oxydatifs, suite à l'irradiation de l'ADN génomique à 295 nm. Cette longueur d'onde correspond à une énergie de 4.2 eV, dans la gamme du rayonnement UVB du Soleil qui arrive sur la surface de la Terre. (soit 4.2 eV, dans la gamme du rayonnement UVB du Soleil qui arrive sur la surface de la Terre). Le mécanisme associé implique des radicaux cationiques [2].
Afin de mieux comprendre les dommages oxydatifs provoqués par le rayonnement UV sur les télomères de l'ADN, les chercheurs du LIDYL et leurs collaborateurs ont entrepris une étude quantitative des électrons émis et des radicaux formés lors de l'irradiation. Pour ceci, ils ont utilisé la spectroscopie d'absorption résolue en temps, couplée à des calculs de chimie quantique. La séquence télomérique humaine, capable de se replier en formant des structures à quatre brins appelées G-quadruplexes, a été plus particulièrement étudiée. Le rendement quantique observé pour l'ionisation à un photon à 266 nm est de 4.5x10-3, comparable à celui d'autres phototoréactions, telles que la dimérisation des bases, bien connues comme source d'endommagement de l'ADN dans ces conditions.
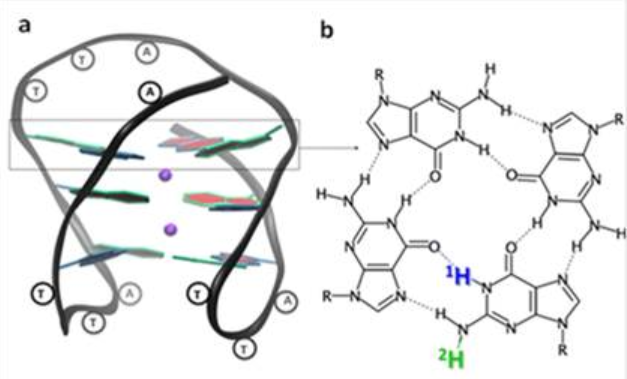
Terminaison G-quadruplex d'une hélice ADN humaine, formée par la séquence télomérique GGGTTAGGGTTAGGGTTAGGG ; les guanines (G) s'associent entre elles par des liaisons hydrogènes en formant des tétrades (b). Après photo-ionisation, la perte d'un proton (bleu ou vert) conduit à la formation de deux radicaux déprotonés différents.
Suite à l'éjection d'électron, les radicaux cations formés peuvent directement réagir ou simplement perdre un proton avant de subir d'autres réactions chimiques. D'un point de vue cinétique, le proton externe (en vert sur la figure), n'étant pas engagé dans des liaisons hydrogènes, peut être perdu en premier, en moins de 2µs. Curieusement, ce n'est qu'après 5 ms que l'on peut observer le radical ayant perdu le proton interne (en bleu) dans le G-quadruplex.
Plusieurs conclusions importantes ont été tirées de ce travail:
La structure secondaire joue un rôle clé pour le phénomène de photo-ionisation qui est détecté uniquement pour des G-quadruplexes et non pas pour la séquence télomérique en simple brin.Trois types de radicaux formés ont été identifiés (le radical cation et deux radicaux externe et interne déprotonés, ayant perdu le proton externe ou le proton interne) ; les réactions chimiques correspondantes restent à découvrir.
Des radicaux cations, qui constituent les porteurs des charges (électrons-trous), survivent dans les G-quadruplexes 1000 fois plus longtemps qu'au sein des simples et doubles hélices d'ADN [3], [4], ce point peut s'avérer utile pour élaborerdes dispositifs nanotechnologiques bio-inspirés.
Note:
*Télomère: région hautement répétitive, donc a priori non codante, d'ADN présente à l'extrémité des chromosomes.
Références:
[1] "Absorption of Low-Energy UV Radiation by Human Telomere G-Quadruplexes Generates Long-Lived Guanine Radical Cations"
A. Banyasz, L. Martinez-Fernandez, C. Balty, M. Perron, T. Douki,R. Improta and D. Markovitsi J. Am. Chem. Soc. 139 2017, 10561.
[2] "Direct oxidative damage of naked DNA generated upon absorption of UV radiation by nucleobases"
M. Gomez-Mendoza, A. Banyasz, T. Douki, D. Markovitsi, and J. L. Ravanat J Phys. Chem. Lett. 7, 2016, 3945.
[3] “UV-induced adenine radicals induced in DNA A-tracts: spectral and dynamical characterization”
A. Banyasz, T. Ketola, A. Muñoz-Losa, S. Rishi, A. Adhikary, M. D. Sevilla, L. Martinez-Fernandez, R. Improrta and D. Markovitsi J. Phys. Chem. Lett. 7 (2016) 3949.
[4] "Adenine radicals generated in alternating AT duplexes by direct absorption of low-energy UV radiation”
A. Banyasz, T. Ketola, L. Martínez-Fernández, I. Improta and D. Markovitsi Faraday Discussions 7, 2017.
Populaires