Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Le phosphate est l'un des minéraux les plus abondants de notre organisme et un constituant majeur des structures cellulaires et des équilibres physiologiques. C'est notamment un composant des acides nucléiques et des membranes, et le balancier de l'équilibre énergétique entre ADP et ATP. De plus, il contrôle l'activité des enzymes et protéines de régulation essentielles que sont les kinases et phosphatases, alors qu'au niveau physiologique, il est le contrepoids ionique du calcium. En conséquence, des dérèglements de la concentration en phosphate sont associés à diverses pathologies sévères. Parmi celles-ci, la calcification cérébrale primaire familiale (CCPF, en anglais PFBC pour "primary familial brain calcification"), qui est une maladie génétique rare, anciennement dénommée maladie de Fahr, est caractérisée par des calcifications du cerveau, notamment au niveau des noyaux gris centraux et de certains noyaux du cervelet. Elle se manifeste par l'apparition de dérèglements neurologiques pouvant survenir à tout âge, mais plus généralement à l'âge adulte. Le malade peut perdre des facultés intellectuelles, motrices et cognitives et présenter des troubles psychiatriques.
À ce jour, trois gènes porteurs de mutations responsables de ce syndrome ont été identifiés: le transporteur de phosphate PiT2/SLC20A2 qui fait partie de la famille des transporteurs de nutriments SLC, et les gènes codant pour le récepteur PDGFR? et son ligand PDGFB. Cependant, la majorité des patients ne présentent aucune mutation dans ces trois gènes, laissant sans réponse la cause de leur maladie.
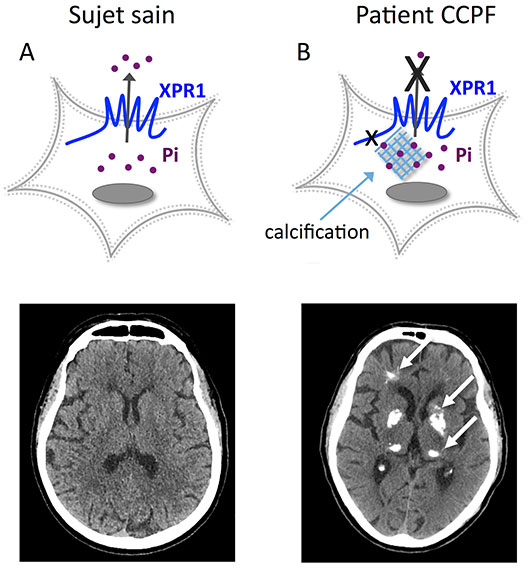
Figure: Schéma d'efflux de phosphate (Pi) normal dans une cellule cérébrale de sujet sain (A) et altérée d'un patient atteint de calcification cérébrale primaire familiale (CCPF) et porteur d'un variant faux sens dans le gène XPR1 avec calcification cérébrale, représentée ici, pour illustration, à l'intérieur de la cellule (B). Scanners cérébraux en coupes axiales des deux sujets. Les flèches blanches indiquent les calcifications des noyaux gris centraux, des thalami, de la substance blanche et du cortex. Pi: phosphate inorganique.
© Donatella Giovannini et Gaël Nicolas
En 2013, Donatella Giovannini, avec ses collaborateurs Jawida Touhami et Pierre Charnet, sous la direction de Marc Sitbon et de Jean-Luc Battini, au sein de l'Institut de Génétique Moléculaire de Montpellier (IGMM), ont découvert le premier exportateur de phosphate chez l'homme . Ce travail précurseur identifiait XPR1 (Xenotropic and Polytropic murine leukemia retrovirus Receptor 1) comme la molécule longtemps recherchée qui assure la sortie du phosphate de la cellule.
L'équipe montpelliéraine montre maintenant que le gène XPR1 est impliqué dans la maladie CCPF/PFBC grâce à une étroite collaboration avec l'équipe de Giovanni Coppola à l'Université de Californie-Los Angeles (UCLA) et l'équipe de Dominique Campion ("Neurogénétique", Inserm U1079 et CHU de Rouen) qui avait été à l'origine de l'identification de mutations du gène PDGFRB dans cette pathologie.
L'équipe californienne suivait depuis plusieurs années 17 personnes d'une même famille nord-américaine dont 9 membres étaient affectés par des calcifications cérébrales primaires. Après séquençage à haut débit de l'exome (ensemble des exons du génome) de 4 individus atteints et d'un parent non atteint, suivi d'une étude de ségrégation dans le reste de la famille, un seul variant était présent chez tous les individus atteints et absent chez les individus sains. Ce variant correspondait à une mutation faux sens dans le gène XPR1, située dans le domaine SPX retrouvé dans plusieurs molécules de plantes et de levure associées à différents niveaux à la chaîne du phosphate. Appuyé par un recrutement national d'échantillons de patients, Gaël Nicolas et ses collaborateurs de l'U1079 ont alors entrepris le séquençage d'XPR1 chez 47 patients français et ont identifié la même mutation que celle trouvée dans la famille américaine, ainsi que 3 nouvelles mutations potentiellement délétères dans XPR1. L'équipe montpelliéraine a étudié l'ensemble des mutations de XPR1 issues des patients et identifié celles qui étaient responsables d'une altération de l'export de phosphate. De plus, Donatella Giovannini et Uriel López-Sánchez, au sein de l'équipe de Marc Sitbon et Jean-Luc Battini à l'IGMM, ont montré que les cellules du sang circulant de patients portant une des mutations délétères avaient un défaut avéré d'export de phosphate.
Ces travaux démontrent que XPR1 est un nouveau transporteur de phosphate impliqué dans les calcifications cérébrales primaires familiales. Les chercheurs émettent l'hypothèse que l'inhibition de l'export de phosphate par les mutations d'XPR1 augmente la concentration intracellulaire de phosphate, entraînant la précipitation du calcium. L'implication directe d'XPR1 dans l'export de phosphate et son profil d'expression dans le cerveau concordent avec son rôle dans l'homéostasie du phosphate cérébral et ouvrent aussi de nouvelles perspectives concernant l'implication de l'homéostasie du phosphate dans les phénomènes de calcification en général.