Deux inversions sexuelles dans un même embryon
Publié par Adrien,
Source: CNRS INSBAutres langues:
Source: CNRS INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les gonades, testicules ou ovaires, sont les acteurs principaux du développement sexuel des mammifères. Les hormones produites par les gonades dirigent la formation de l'appareil génital femelle ou mâle au cours de la vie embryonnaire, puis contrôlent les caractères sexuels secondaires, la reproduction, mais aussi la physiologie et le vieillissement à l'âge adulte. Malgré ce rôle central, la compréhension des bases moléculaires et cellulaires de la différenciation testiculaire et ovarienne demeure très partielle. Ainsi, 50% des anomalies du développement sexuel (ADS) chez l'Homme ont à ce jour des causes inconnues.
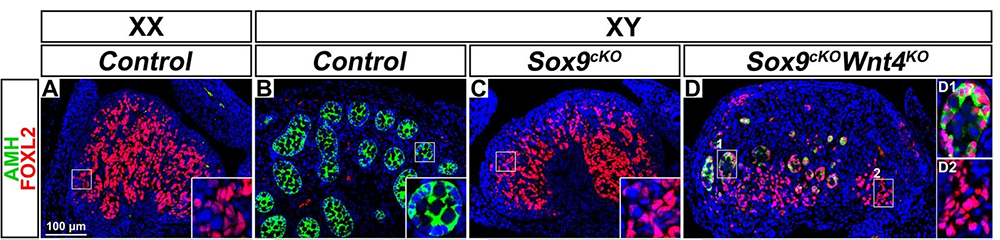
Immunodétection des protéines FOXL2 (rouge) et AMH (vert) dans les gonades embryonnaires de souris:
- FOXL2 marque les cellules de soutien dans l'ovaire contrôle XX (A).
- AMH est exprimé dans les cellules de soutien du testicule contrôle XY (B).
- Les gonades XY mutantes pour Sox9 se développent comme des ovaires exprimant FOXL2 (C).
- Les gonades XY double mutantes pour Sox9 et Wnt4 se développent comme des ovo-testicules (D).
- Dans la partie postérieure le marqueur ovarien FOXL2 est exprimé (D2), alors que dans la partie antérieure les cellules de soutien co-expriment FOXL2 et AMH, et se trans-différencient en cellules testiculaires (D1).
© Furong Tang & Aitana Perea-Gomez
Quel que soit leur sexe, les embryons de souris possèdent initialement une gonade indifférenciée qui se développe en testicule ou en ovaire chez les individus XY ou XX respectivement. Les facteurs de transcription SRY/SOX9 orchestrent la différenciation testiculaire, et en absence deSox9 les souris XY développent des ovaires à la place des testicules. Chez les individus XX, la voie de signalisation RSPO1/WNT4/ß-caténine contrôle le développement des ovaires. Les mutations dans cette voie conduisent à la formation d'ovo-testicules, des gonades avec des caractéristiques à la fois d'ovaire et de testicule. Les cascades génétiques mâle et femelle s'opposent. Ainsi chez les mutants XY Sox9, la protéine WNT4 est anormalement active. Est-elle responsable pour autant de la formation d'un ovaire dans ce cas d'inversion sexuelle ? Afin de répondre à cette question, les scientifiques ont généré des souris portant deux mutations, une dans le gène pro-testiculaire Sox9 et l'autre dans le gène pro-ovarien Wnt4.
En analysant les gonades XY mutantes pour Sox9 et Wnt4 à différentes étapes du développement, cette étude a révélé deux inversions sexuelles successives au sein d'un même individu. Dans une première étape, la gonade XY double mutante suit un destin ovarien (inversion mâle-femelle). Ce résultat montre que WNT4 n'est pas nécessaire pour former un ovaire dans les mutants XY Sox9, et suggère qu'une autre cascade génétique peut initier la différentiation ovarienne lorsque la signalisation WNT4/ß-caténine est déficiente. Cependant, en fin de gestation, une partie des cellules ovariennes de gonades XY doubles mutantes pour Sox9 et Wnt4 ne sont pas maintenues et se transforment en cellules typiques du testicule (inversion femelle-mâle), pour former un ovo-testicule. Cette observation révèle que la fonction de Wnt4 est indispensable pour le maintien de l'identité des cellules ovariennes, y compris dans le contexte d'une inversion sexuelle.
Ces travaux ont permis d'identifier des étapes du développement des gonades de souris contrôlées de façon séquentielle et indépendante par Sox9 et Wnt4, et pourront contribuer à la compréhension de l'étiologie de certaines anomalies du développement sexuel.
Pour en savoir plus:
Mouse Gonad Development in the Absence of the Pro-Ovary Factor WNT4 and the Pro-Testis Factor SOX9.
Tang F, Richardson N, Albina A, Chaboissier M-C , Perea-Gomez A.
Cells 29 avril 2020. doi.org/10.3390/cells9051103
Laboratoire:
Institut Biologie Valrose (iBV) - (CNRS/Inserm/Université Côte d'Azur)
Parc Valrose, 06108 NICE cedex 2, France.