Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
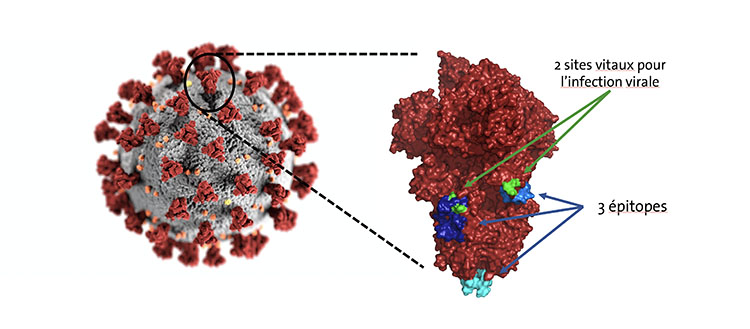
Localisation des trois sites ciblés le plus fréquemment par les anticorps humains sur les clous (ou "spikes") du coronavirus responsable du COVID-19.
@ UNIGE
Les tests sérologiques permettent de savoir si une personne a développé ou non des anticorps contre le coronavirus responsable du COVID-19. Mais ils n'informent pas sur la partie précise du virus à laquelle s'amarrent les anticorps, une donnée pourtant essentielle dont dépend la capacité du système immunitaire humain à neutraliser le pathogène et à juguler l'infection. Comme ils le rapportent dans un article déposé sur MedRxiv (une archive de prépublications consacrée à la recherche médicale), des scientifiques de l'Université de Genève et des Hôpitaux universitaires de Genève (HUG) ont identifié trois des cibles (appelées épitopes linéaires) les plus souvent sélectionnées par les anticorps d'un groupe de patients et patientes ayant eu le COVID-19. Il se trouve que deux de ces épitopes sont impliqués dans le processus utilisé par le virus pour relâcher son matériel génétique dans les cellules humaines. L'identification de telles cibles très spécifiques, surtout si elles s'avèrent neutralisantes (ce que l'on ignore encore), est d'une grande importance pour le développement de vaccins et de traitements efficaces.
"Le corps humain produit sans arrêt, de manière aléatoire, des anticorps d'une très grande diversité, explique Nicolas Winssinger, professeur au Département de chimie organique de la Faculté des sciences de l'UNIGE. Il y en a des milliers de milliards, tous différents, et ils attendent un éventuel envahisseur pour s'y attacher et le désigner au système immunitaire comme une cible à détruire. Quand survient un agent pathogène nouveau, comme le SARS-Cov-2, quelques-uns de ces anticorps ont la capacité de s'amarrer à lui et de déclencher une réponse efficace du système immunitaire. Mais tout le monde ne sélectionne pas les mêmes anticorps ni, par conséquent, ne développe la même réponse immunitaire."
L'épidémie actuelle de COVID-19 se distingue en effet par la grande diversité de réponses au coronavirus. Certaines personnes ne se rendent simplement pas compte qu'elles sont infectées, d'autres sont affreusement malades, voire en meurent.
Point d'amarrage
Afin de mieux comprendre cette diversité, les équipes de Nicolas Winssinger et de Nicolas Vuilleumier, professeur au Département de médecine de la Faculté de médecine de l'UNIGE et médecin chef du Service de médecine de laboratoire aux HUG ont tenté de savoir quels anticorps sont préférentiellement sélectionnés chez les personnes ayant eu le COVID-19 et surtout à quels endroits précis de l'agent infectieux ils s'amarrent. La cible spécifique des anticorps s'appelle l'épitope.
Douze patientes et patients ont participé à l'étude et les résultats confirment que les réponses ne sont de loin pas uniformes. Le seul point commun entre tous les anticorps générés par les participants, c'est qu'ils visent les "clous" - ou spikes - qui couvrent la surface des coronavirus et auxquels ils doivent leur nom. Mais ils s'amarrent à des endroits très différents de ces grandes protéines. Les scientifiques ont néanmoins identifié trois zones les plus fréquemment sélectionnées. Et deux d'entre elles correspondent à des points d'accroche indispensables à des protéines spéciales (protéases) qui permettent au coronavirus de fusionner avec la membrane cellulaire et de relâcher son matériel génétique à l'intérieur de sa proie.
Tête ou base du clou ?
"Nous avons été surpris par ce résultat, précise Nicolas Winssinger. Jusqu'à présent, la plupart des efforts dans ce domaine se sont concentrés sur la partie supérieure du "clou", celle dont on sait qu'elle permet au coronavirus de s'attacher à la cellule cible. La fusion du virus avec la cellule n'en représente que la deuxième étape mais elle est en réalité plus décisive."
En effet, le fait de s'accrocher à une cellule n'assure pas encore au virus de pouvoir fusionner avec elle. De plus, le problème avec la partie supérieure du "clou", c'est qu'elle ne représente pas forcément une cible idéale pour un médicament ou un vaccin. Elle peut même s'avérer dangereuse. Des études effectuées sur des singes infectés par le SARS-Cov1, le virus responsable de l'épidémie de 2003 et faisant partie de la même famille des coronavirus, ont montré que des anticorps s'attachant à cet endroit non seulement n'empêchent pas toujours les virus de s'attacher à leurs cellules cible mais, en plus, les redirigent vers d'autres types de cellules, provoquant ainsi l'apparition de maladies secondaires (ADE antibody-dependent enhancement of diseases).
Les deux épitopes identifiés par les auteurs genevois, quant à eux, sont impliqués dans un processus très différent. Ils pourraient donc offrir une alternative plus prometteuse - et moins risquée - dans la recherche d'un nouveau traitement ou vaccin. Mais avant cela, il faudrait d'abord évaluer le pouvoir neutralisant des anticorps correspondants.
Publication:
Cette recherche a été déposée sur MedRxiv
DOI: https://doi.org/10.1101/2020.06.15.20131391
Contacts:
- Nicolas Winssinger - Professeur ordinaire -Département de chimie organique - Faculté des sciences- nicolas.winssinger at unige.ch
- Nicolas Vuilleumier - Professeur associé - Département de médecine de la Faculté de médecine - Médecin chef - Service de médecine de laboratoire, HUG - nicolas.vuilleumier at hcuge.ch