Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Pourquoi certaines personnes souffrent de détresse respiratoire aigüe, alors que d'autres n'ont aucun symptôme ? Est-ce parce que leur système immunitaire est trop faible que les personnes âgées en meurent si souvent ? La réponse à cette question n'est pas simple, parce que le système immunitaire met en cause une grande variété de mécanismes qu'on peut séparer, en gros, en 3 lignes de défense.
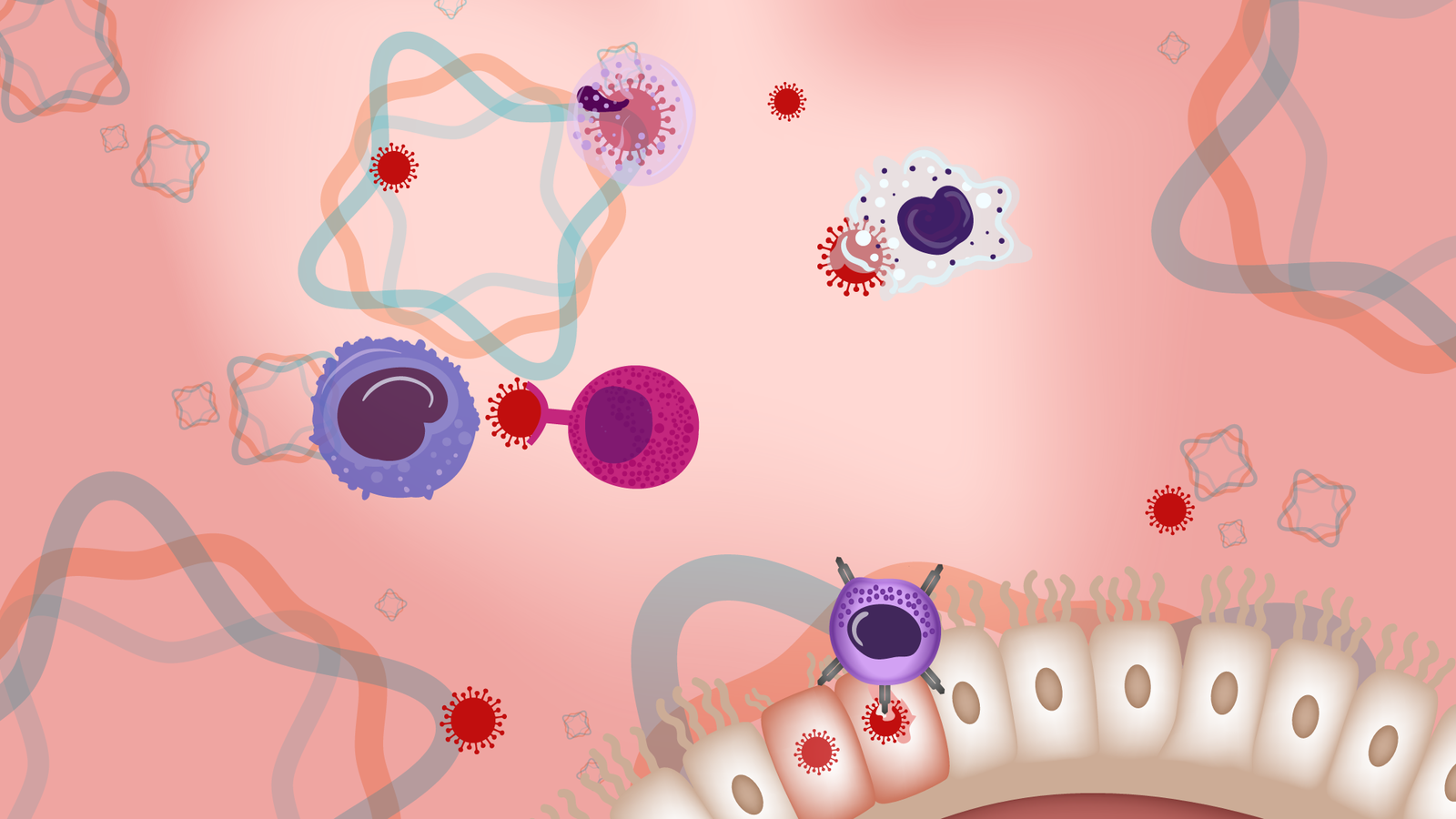
La première ligne de défense: les barrières physiques et chimiques
Aucun virus ne peut se multiplier par lui-même. Pour y parvenir, il doit d'abord se greffer à une cellule, y insérer son génome et la forcer à fabriquer des copies de lui-même. Cette prise de contrôle ne réussit pas chaque fois. Car le virus qui entre dans les voies respiratoires ou digestives rencontre une première ligne de défense formée des muqueuses et des cellules épithéliales qui tapissent l'intérieur de la bouche et du nez (barrières physiques), ainsi que des sécrétions comme le mucus, la salive, les larmes et le suc gastrique (barrières chimiques). Les cellules épithéliales des voies respiratoires sont munies de petits poils qui ont pour fonction de repousser les corps étrangers vers la sortie.Or, ce qui rend le coronavirus de la Covid si contagieux, c'est qu'il est doté de protéines de surface qui s'arriment spécifiquement aux récepteurs ACE2, présents sur la membrane de ces cellules épithéliales censées nous protéger. Si le nombre de virus introduits par la respiration est suffisamment grand, quelques-uns réussiront, malgré la première ligne de défense, à s'attacher à cette membrane des cellules et à y insérer leur ARN. Dès lors, l'infection commence.
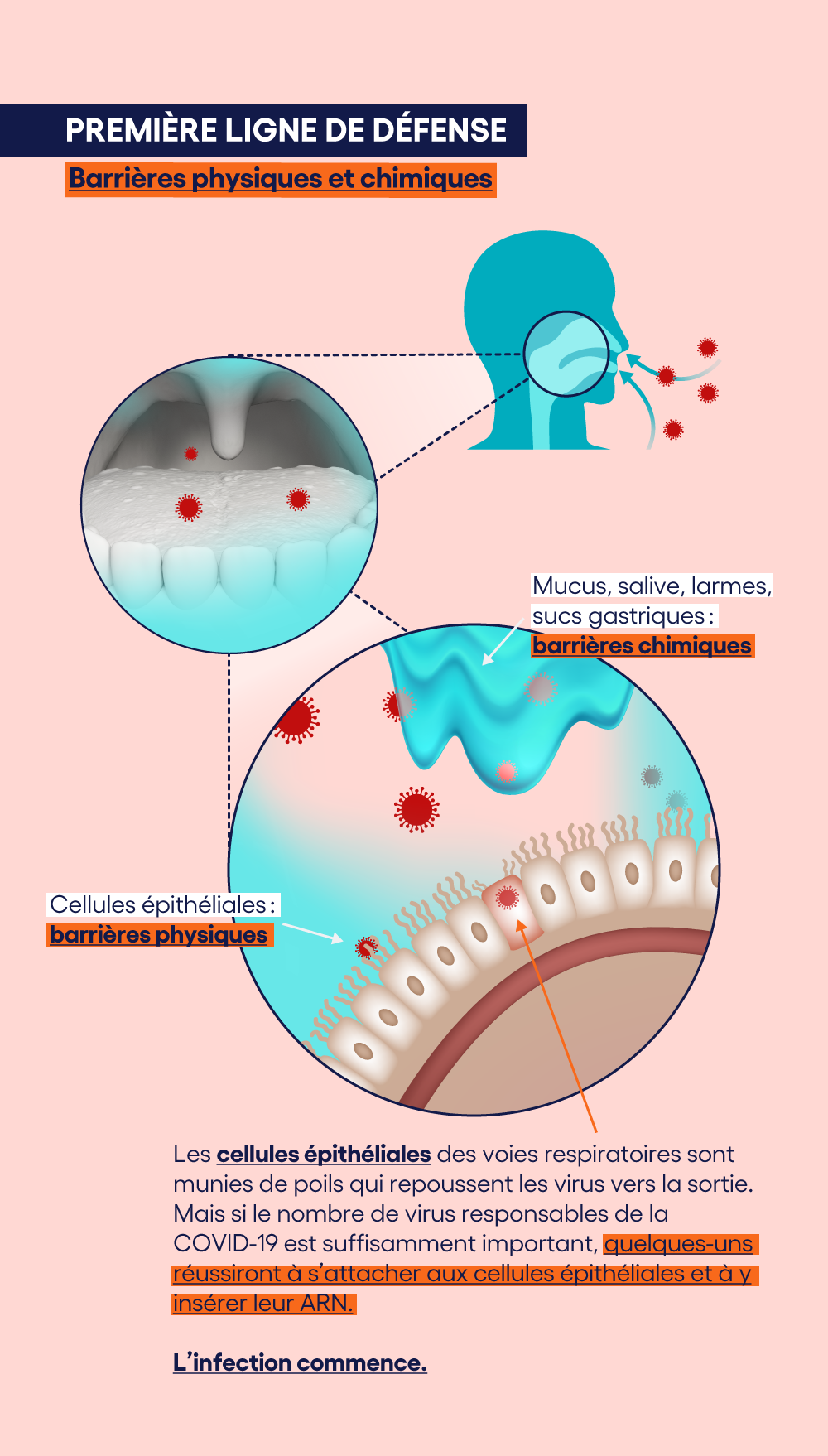
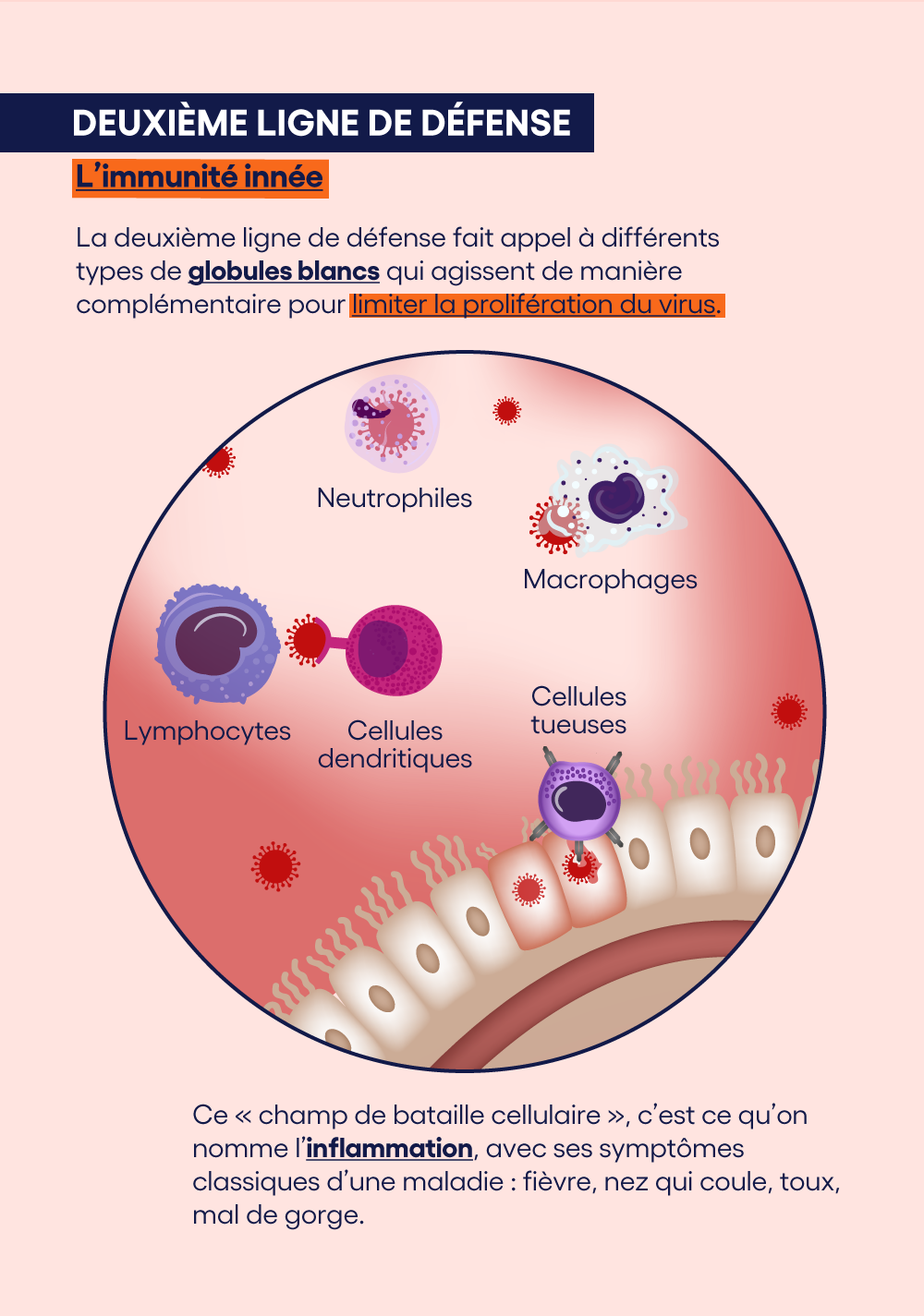
La deuxième ligne de défense: l'immunité innée
Entre alors en jeu la deuxième ligne de défense, qui doit empêcher (ou du moins maîtriser) cette prolifération. Elle fait appel aux différents types de globules blancs qui agissent de manière complémentaire.Les macrophages et les neutrophiles, par exemple, vont reconnaître les virus et vont les "avaler".
Les cellules dendritiques vont, pour leur part, isoler les protéines de surface des virus (les “antigènes”) et les présenter aux lymphocytes T, qui pourront ainsi s'adapter de manière spécifique à ces antigènes viraux, et détruire les innombrables virus fabriqués en série.
En parallèle, les cellules tueuses NK (Natural Killers), vont attaquer non pas les virus, mais plutôt les cellules épithéliales qu'ils ont piratées et qui sont dès lors devenues des usines à virus.
Dans cette guerre contre les intrus, les nombreuses cellules du système immunitaire inné produisent aussi toute une gamme de protéines (histamine, protéases, prostaglandines, héparine, cytokines, interféron, facteurs de croissance, compléments) qui jouent de multiples rôles pour éliminer les virus.
Par exemple, des vasodilatateurs vont permettre aux vaisseaux sanguins d'amener plus de sang et de globules blancs sur le site de l'attaque. Des facteurs de croissance vont accélérer le renouvellement des cellules épithéliales, pour remplacer les cellules infectées détruites par les cellules tueuses NK. Et les cytokines vont jouer le rôle de messagers pour mobiliser les renforts de globules blancs sur le site de l'infection, pour activer les cellules responsables du "nettoyage" des intrus, ou inhiber la réplication virale à l'intérieur des cellules, par exemple.
Tout cela engendre une activité intense sur-le-champ de bataille cellulaire. C'est ce qu'on appelle une inflammation. Elle laisse, sur place, des cadavres et des débris. L'organisme va réagir en tentant d'éjecter ces déchets. Ce sont les symptômes classiques de la maladie: fièvre, augmentation de la production de mucus, nez qui coule, toux, mal de gorge...
Quand les virus pénètrent dans les alvéoles pulmonaires, l'inflammation, la destruction des cellules et l'accumulation des débris rendront la respiration plus difficile. Si l'infection atteint aussi les vaisseaux sanguins, ces débris peuvent alors entraver la circulation du sang et provoquer la formation de caillots (thromboses). Ces réactions seront plus ou moins intenses selon la génétique ou l'état de santé des individus, mais aussi selon l'étendue de l'infection initiale.
L'équilibre entre toutes les molécules impliquées dans la défense immunitaire est délicat. On parle d'une "hyper-inflammation" ou d'une "tempête de cytokines" lorsque l'organisme réagit de façon disproportionnée. C'est ce qui a causé la majorité des décès liés à la grippe espagnole, au siècle dernier. C'est aussi ce qui explique la grande majorité des cas de détresse respiratoire qui sont survenus avec le SRAS en 2003, et avec la Covid-19 maintenant.
Cette hyper-inflammation peut se propager à tout l'organisme et provoquer une infection généralisée. Les patients peuvent alors mourir d'insuffisance rénale, de troubles hépatiques ou d'une trop forte baisse de tension artérielle.
La troisième ligne de défense: l'immunité adaptative
Cela nous amène à la troisième phase de la défense immunitaire qui prend deux formes: la levée d'une armée de cellules équipées pour détruire de manière spécifique l'envahisseur (réponse cellulaire), et la production massive d'anticorps capables de paralyser rapidement ce même envahisseur (réponse humorale). Cette double réponse immunitaire, parce qu'elle est plus spécifique, est beaucoup plus efficace. Mais il lui faudra quelques jours avant de se déployer.Par contre, une fois en production, ces cellules de la deuxième vague et ces anticorps demeurent présents dans l'organisme. Abondants dans les semaines ou les mois qui suivent une infection, ils demeurent latents pendant des mois, des années, voire pour toujours. Ce sont eux qui permettent à la personne qui a déjà souffert d'une maladie, d'être désormais immunisée.
C'est la base de la vaccination: permettre aux gens d'être immunisés à l'avance en les exposant à des fragments du virus (des bouts d'ARN ou des protéines virales par exemple) afin qu'ils aient le temps de fabriquer des anticorps avant même d'être infectés.

Plusieurs médicaments mis à l'essai contre la Covid-19 étaient des antiviraux (le Remdesivir, par exemple), mais on a aussi testé quelques anti-inflammatoires connus.
C'est le cas de l'hydroxychloroquine, un antipaludéen dont on a démontré, in vitro, une certaine efficacité antivirale, mais qui est surtout connu pour ses effets anti-inflammatoires, dans le traitement de maladies auto-immunes comme le lupus. Si les recherches n'ont pas encore permis de confirmer l'efficacité de ce médicament contre la Covid-19, des chercheurs britanniques ont annoncé en juin que la dexaméthasone, un corticostéroïde anti-inflammatoire très connu, aurait réduit du tiers la mortalité chez les patients qui étaient intubés ou alimentés en oxygène.
Mais attention: les résultats de cette recherche n'ont pas encore fait l'objet d'une publication révisée par les pairs, et les chercheurs responsables de l'étude ont aussi mentionné que le médicament n'aurait eu aucun effet significatif, chez les patients dans un état moins critique.
Ce n'est pas étonnant. La réaction inflammatoire est un élément essentiel dans la défense immunitaire. Utiliser trop tôt un médicament susceptible d'inhiber cette réaction risque donc de faire plus de tort que de bien. Cela explique pourquoi les autorités médicales recommandent encore fortement de ne pas utiliser ces médicaments pour traiter les personnes atteintes de la Covid... sauf à l'urgence, en phase critique.
Une autre illustration de la complexité du système immunitaire, et de la difficulté de trouver un médicament universel !
Populaires