Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
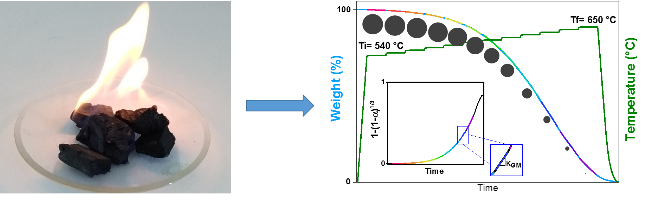
Bien qu'à l'origine de la dernière révolution industrielle et particulièrement étudiée depuis une cinquantaine d'années, la réaction de combustion du carbone cache encore bien des mystères. Les liens entre sa cinétique, c'est-à-dire la vitesse de la réaction, et la température ou la quantité d'oxygène consommée sont en effet mal connus. En effet, certaines interactions physiques masquent les processus chimiques de l'oxydation du carbone (C) en dioxyde de carbone (CO2). Des chercheurs du Centre de Recherche Paul Pascal (CRPP, CNRS/Université de Bordeaux) et du Centre interuniversitaire de recherche et d'ingénierie des matériaux (CIRIMAT, CNRS/Université Toulouse Paul Sabatier/INP Toulouse) ont contourné cette difficulté en proposant une nouvelle méthode, dite des isothermes successives.
Leur approche est basée sur l'analyse thermogravimétrique, qui mesure la perte de masse de l'échantillon en fonction de la température. D'habitude, ces mesures sont effectuées en plusieurs fois à une température constante différente, ce qui permet d'obtenir le diagramme de la cinétique de la réaction: le diagramme d'Arrhenius. L'équipe du CRPP est parvenue à recueillir suffisamment de données pour construire le diagramme en une seule mesure, ce qui ne prend que quatre à six heures contre plusieurs jours en temps normal. Leurs résultats montrent des comportements inattendus du carbone. En effet, à partir de certaines températures, la quantité d'oxygène nécessaire à la réaction augmente, ce qui suggérerait que le carbone s'oxyde d'abord en monoxyde de carbone (CO), puis en CO2. Ensuite, dans certains cas, l'énergie nécessaire à l'activation de la réaction augmente aux hautes températures, ce qui n'était pas non plus prévu. Une meilleure compréhension de ces phénomènes pourrait permettre un contrôle meilleur et donc plus propre de la production d'énergie. Les chercheurs continuent d'explorer l'oxydation du carbone, tout en soulignant que leur méthode des isothermes successives s'applique à d'autres combustions.
Références:
Emmanuel Picheau, Ferdinand Hof, Alain Derré, Barbara Daffos et Alain Pénicaud.
Thermal oxidation of carbonaceous nanomaterials revisited: evidences of mechanism changes
Angewandte Chemie International Edition - Juillet 2019
DOI: 10.1002/ange.201906026